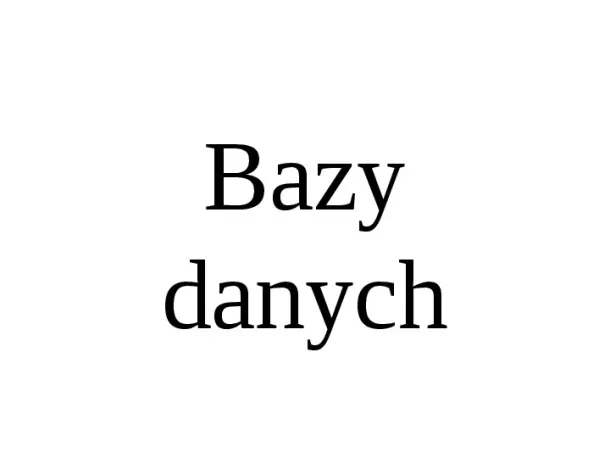Zobacz slidy
Treść prezentacji
Slide 1
Wyszukiwanie informacji w Internecie . 1
Slide 2
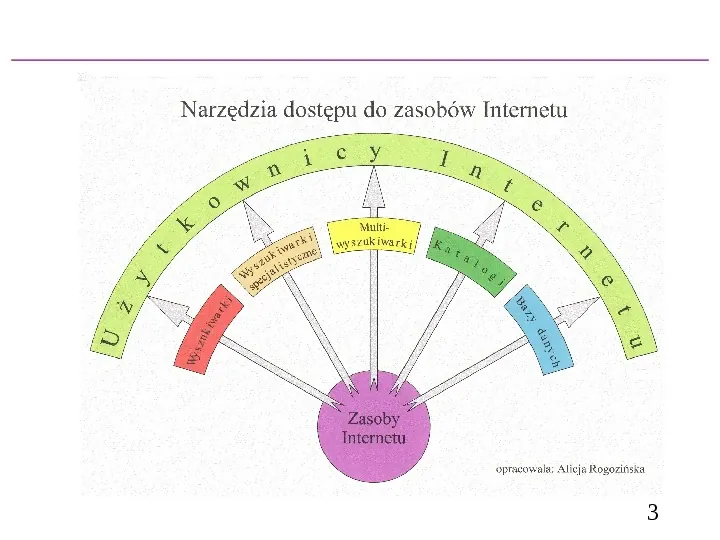
Spis treści prezentacji pt. Wyszukiwanie informacji w Internecie 1. Narzędzia dostępu do Internetu 2. Narzędzia wyszukiwawcze Wyszukiwarki Wyszukiwarki specjalistyczne Multiwyszukiwarki Katalogi Bazy danych 3. Wyszukiwanie w sieci Wyszukiwarki polskojęzyczne Wyszukiwarki globalne Katalogi stron www Portale polskojęzyczne Multiwyszukiwarki polskojęzyczne Multiwyszukiwarki globalne Katalogi wyszukiwarek Portale polskojęzyczne 4. Praktyczne rady przy wyszukiwaniu 2
Slide 3
3
Slide 4
Według badań, za pomocą wyszukiwarek można mieć dostęp do zaledwie 16 zasobów Internetu objętych globalną pajęczyną. Informacja w Internecie nie ma hierarchii ważności, o jej wyborze decyduje sam użytkownik Informacje w Internecie są przedstawiane bez opinii Internet umożliwia całodobowy dostęp do informacji Internet zawiera wiele informacji niedokładnych Internet nie może być jedynym źródłem informacji Internet podlega ciągłym zmianom 4
Slide 5
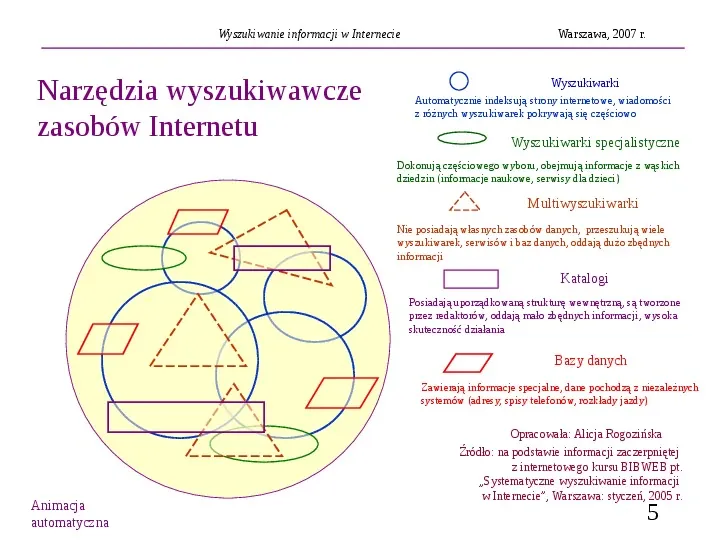
Wyszukiwanie informacji w Internecie Narzędzia wyszukiwawcze zasobów Internetu Warszawa, 2007 r. Wyszukiwarki Automatycznie indeksują strony internetowe, wiadomości z różnych wyszukiwarek pokrywają się częściowo Wyszukiwarki specjalistyczne Dokonują częściowego wyboru, obejmują informacje z wąskich dziedzin (informacje naukowe, serwisy dla dzieci) Multiwyszukiwarki Nie posiadają własnych zasobów danych, przeszukują wiele wyszukiwarek, serwisów i baz danych, oddają dużo zbędnych informacji Katalogi Posiadają uporządkowaną strukturę wewnętrzną, są tworzone przez redaktorów, oddają mało zbędnych informacji, wysoka skuteczność działania Bazy danych Zawierają informacje specjalne, dane pochodzą z niezależnych systemów (adresy, spisy telefonów, rozkłady jazdy) Opracowała: Alicja Rogozińska Animacja automatyczna Źródło: na podstawie informacji zaczerpniętej z internetowego kursu BIBWEB pt. Systematyczne wyszukiwanie informacji w Internecie, Warszawa: styczeń, 2005 r. 5
Slide 6
Wyszukiwarki Automatycznie indeksują strony internetowe Obejmują wycinek zasobów Internetu Wiadomości z różnych wyszukiwarek częściowo pokrywają się Strategia wyszukiwania: należy podać precyzyjnie hasło Zalety: szybkie i proste wyniki wyszukiwania 6
Slide 7
Wyszukiwarki specjalistyczne Dokonują częściowego wyboru według treści Najczęściej są kontrolowane przez redaktorów Obejmują informacje z wąskich dziedzin (informacje naukowe, serwisy dla dzieci, informacje z archiwów) Strategia wyszukiwania: informacje znajdują się w bazach i serwisach edukacyjnych, encyklopediach, słownikach 7
Slide 8
Multiwyszukiwarki Nie posiadają własnych zasobów danych Każda multiwyszukiwarka przeszukuje obszary wielu wyszukiwarek, serwisów i baz danych Duża liczba przeszukiwanych źródeł Dużo zbędnych informacji (szum informacyjny) Strategia wyszukiwania: należy podać hasło wyszukiwania, przeprowadzić selekcję po wyświetleniu, wybrać poprawne hasło Zalety: przeszukanie w krótkim czasie obszernych zasobów 8
Slide 9
Katalogi Posiadają uporządkowaną strukturę wewnętrzną według określonych kategorii z możliwością przeszukiwania Katalogi są tworzone przez redaktorów i obejmują strony o istotnej treści W porównaniu z wyszukiwarkami mniej zbędnych informacji, mniej stron do przeglądania Strategia wyszukiwania: przeglądanie krok po kroku lub przeglądanie poszczególnych kategorii Zalety: wysoka skuteczność działania 9
Slide 10
Bazy danych Zawierają informacje specjalne Dostęp do baz osiąga się przez Internet Dane pochodzą z niezależnych systemów (adresy, spisy telefonów, rozkłady jazdy itp.) 10
Slide 11
Wyszukiwanie w sieci: Wyszukiwarki polskojęzyczne (przykłady) 1. NEToskop: dostosowany do specyfiki języka polskiego (uwzględnia znaki diakrytyczne) 2. NET.sprint: najszybsza wyszukiwarka o dużej wydajności i precyzji prezentowania wyników Zalety: elastyczny mechanizm prezentacji wyników, dostęp do archiwum 11
Slide 12
Wyszukiwanie w sieci: Wyszukiwarki polskojęzyczne (przykłady) 3. Szukacz: przygotowany do wyszukiwania dokumentów w języku polskim, pozwala na budowanie skomplikowanych pytań, pokazuje fragmenty wyszukanych dokumentów z szukanymi słowami 4. Yandex: umożliwia przeszukiwanie zasobów polskiego Internetu, pozwala na zadawanie skomplikowanych pytań, odznacza się dużą trafnością odpowiedzi 12
Slide 13
Wyszukiwanie w sieci: Wyszukiwarki globalne (wybrane przykłady) 1. Google: dzięki metodzie oceny selekcji wyników odznacza się wysoką skutecznością wyszukiwania i większością poprawnych wyników, jest wygodna do stosowania. Zalety: jest szybka (mało reklam, prosta szata graficzna) automatycznie łączy operatorami kilka haseł nie uwzględnia wielkich i małych liter realizuje wyszukiwanie nawet przy źle wpisanych terminach 13
Slide 14
Wyszukiwanie w sieci: Wyszukiwarki globalne (wybrane przykłady) 2. MSN Microsoft Network: zawiera kilka kategorii tematycznych, redagowany jest zasób 2000 najczęściej odwiedzanych tematów, zawiera katalog synonimów 3. AltaVista: jest jedną z największych wyszukiwarek pod względem ilości zaindeksowanych stron, wyszukiwanie jest wspierane przez inne katalogi, wyszukiwanie zaawansowane wymaga stosowania operatorów Boolea 14
Slide 15
Wyszukiwanie w sieci: Wyszukiwarki globalne (wybrane przykłady) 4. AlltheWeb (Fast): dąży do połączenia całego Internetu w jeden wspólny indeks jest największą wyszukiwarką pełnotekstową na świecie (obejmuje 2.1 miliarda stron) przy wyszukiwaniu można używać operatorów oferuje wyszukiwanie stron www, rysunków, nagrań wideo, plików PM3 i FTP 15
Slide 16
Wyszukiwanie w sieci: Wyszukiwarki globalne (wybrane przykłady) 5. HotBot: nie rozwinęła własnej technologii, bazuje na systemie Inktomi wyszukiwanie prowadzi się w zaznaczonej opcji: wszystkie słowa (AND), przynajmniej jedno - OR oraz: cała fraza, osoba, link, operacja Boolea, data, język, rodzaj danych, pliki MP3, grafiki 16
Slide 17
Wyszukiwanie w sieci: Wyszukiwarki globalne (wybrane przykłady) 6. Overture: zawiera funkcję oceny wartości wyników wyszukiwania rezerwuje najbardziej atrakcyjne miejsca do prezentacji świadczy usługi internetowe na rzecz większych wyszukiwarek 17
Slide 18
Wyszukiwanie w sieci: Katalogi stron www (wybrane przykłady) 1. Katalog Wirtualnej Polski: jest opracowywany przez zespół redaktorów katalog liczy ponad 10 milionów stron, umieszczonych w 16 głównych kategoriach, dużym ułatwieniem dla użytkowników jest poradnik pomocy i serwis FAQ oraz mapa katalogu 2. Onet.pl OKO: posiada 400 tysięcy polskich stron www i jest najpopularniejszym redagowanym katalogiem, posiada możliwość dodawania adresów oraz wewnętrzną wyszukiwarkę, w katalogu jest mapa całego katalogu i poszczególnych kategorii 18
Slide 19
Wyszukiwanie w sieci: Katalogi stron www (wybrane przykłady) 3. Yahoo: jest wspomagany przez wyszukiwarkę Google, posiada ok. 2 mln. redagowanych wpisów, wielkie i małe litery nie są uwzględniane, istnieje możliwość łączenia haseł operatorami I oraz LUB, jeśli żadne hasło nie zostało znalezione, automatycznie przechodzi do serwisu Inktomi, na stronie początkowej można znaleźć: linki do aktualnych tematów (nagłówki, finanse, sport, muzyka, usługi (pogoda, e-kartki, e-mail, chat, zakupy, aukcje, panoramę firm itd. 19
Slide 20
Wyszukiwanie w sieci: Katalogi stron www (wybrane przykłady) 4. Open Directory DMOZ: jest redagowany przez społeczność internetową, każdy użytkownik może być moderatorem danej kategorii i ponosić odpowiedzialność za jej zawartość, z katalogu korzystają: Google, Yahoo, Netscape, Lykos, HotBot, zawiera około 5,5 miliona stron Polska wersja Open Directory liczy 73.000 wpisów 20
Slide 21
Wyszukiwanie w sieci: Katalogi stron www (wybrane przykłady) 5. Looksmart: duża liczba kategorii tematycznych, redagowanych przez około 200 redaktorów, ponad 60.000 kategorii tematycznych, 1 milion wpisów, na stronie startowej znajduje się drzewo kategorii tematycznych, jeśli nie znajdzie hasła przechodzi do zasobów Inktomi, umożliwia przeszukiwanie baz danych z opracowaniami naukowymi z różnych dziedzin, zawartość katalogu jest weryfikowana na bieżąco i wzbogacana o nowe publikacje, stare informacje lub niepełne są usuwane 21
Slide 22
Wyszukiwanie w sieci: Portale polskojęzyczne (wybrane przykłady) 1. Wirtualna Polska: katalog powstał w 1995 r. umożliwia przeszukanie polskich i globalnych zasobów Internetu wspierany jest przez wyszukiwarki Google i NetSprint jest platformą komunikacyjną spotkań i wymiany informacji (Czat, Forum, Debaty, Kontakt, Spotkania), na której można m.in. zawrzeć znajomość, pograć w szachy, posłuchać muzyki z MP3 22
Slide 23
Wyszukiwanie w sieci: Portale polskojęzyczne (wybrane przykłady) 2. Onet.pl: umożliwia dostęp do najważniejszych informacji z Polski i ze świata w 11 serwisach tematycznych, np.: rynek finansowy (banki, podatki, giełda itd.), informacja (encyklopedie, słowniki, bazy teleadresowe), nowinki technologiczne (m.in. e-podpis, WAP, wirusy), rozrywka (m.in. konkursy, galerie), ogłoszenia, aukcje itd., kontakty (e-mail, e-kartki, czat itp.) 23
Slide 24
Wyszukiwanie w sieci: Portale polskojęzyczne (wybrane przykłady) 3. Interia: portal powstał w 1999 r., informacje są zgromadzone w serwisach tematycznych, treści zamieszczone w serwisach są redagowane przez zespół redakcyjny oraz przejmowane z gotowych internetowych serwisów, prezentacja informacji jest wzbogacona elementami multimedialnymi (fotosy, wideo, dźwięk), portal umożliwia przeszukiwanie informacji przez wyszukiwarki AltaVista i Google, umożliwia użytkownikom komunikację za pomocą poczty elektronicznej, kartek elektronicznych, czatu (CZAeria), forum dyskusyjnego (Hyde Park) 24
Slide 25
Wyszukiwanie w sieci: Portale polskojęzyczne (wybrane przykłady) 4. Gazeta.pl: portal powstał z serwisu Gazety Wyborczej, jest jednym z ważniejszych źródeł informacji w polskim Internecie struktura mapy serwisu portalu: nowości, serwisy tematyczne, Gazeta Wyborcza i serwisy informacyjne, serwisy specjalne, serwisy regionalne, usługi internetowe (czat, e-mail, forum dyskusyjne, www, wyszukiwarka AltaVista) 25
Slide 26
Wyszukiwanie w sieci: Portale polskojęzyczne (wybrane przykłady) 5. Gery.pl: powstał na bazie płatnych serwisów komputerowych, otrzymał dwie statuetki prestiżowego konkursu: Most Popular oraz Best Information, prowadzi m.in. serwis poświęcony Unii Europejskiej 6. Hoga.pl: od 2002 r. stał się portalem usługowym, realizującym potrzeby informacyjne małych i średnich firm, instytucji i osób prywatnych, świadczy nadal usługi bezpłatne: www, wyszukiwarki: Google, NetSprint; konta e-mail, serwisy: Hardware, Software, Gry komputerowe, Banki 26
Slide 27
Wyszukiwanie w sieci: Multiwyszukiwarki polskojęzyczne 1. Emulti: pracuje równolegle zadaje pytania kilku wyszukiwarkom w tym samym czasie (AltaVista, Excite, HotBot, Netoskop, Infoseek, WebCrawler) przerywa połączenie po pobraniu właściwych danych usuwa duplikaty sortuje w zależności od wagi informacji losuje i wyświetla wyniki 27
Slide 28
Wyszukiwanie w sieci: Multiwyszukiwarki polskojęzyczne 2. Siec.pl: pozwala na przejrzyste definiowanie kryteriów obróbki danych i tworzonych zapytań, zawiera 4 specjalistyczne technologie: Solution Progres Scan (Skanowanie Postępu rozwiązania) system śledzenia postępów i stopnia zaawansowania procesów, Stealth Active Cash (ukryty Bufor Aktywny) system skracający czas oczekiwania na wynik, Deep Pl Searching (Głębiej w PL) pozwala zwiększyć o 10-15 liczbę wyszukanych odpowiedzi, True Target (Trafny Strzał) system przetwarzania i punktowania zwróconych wyników 28
Slide 29
Wyszukiwanie w sieci: Multiwyszukiwarki polskojęzyczne 3. szukaj.premiera.pl: umożliwia wyszukiwanie informacji: z ponad 2 miliardów stron www, ok. 300 milionów zdjęć, obrazków, kilku milionów plików MP3, przeszukuje równolegle wyszukiwarki: Google, AltaVista, HotBot, AlltheWeb, Abacho, Lycos, 2look4 , operatory i hasła przekazuje kolejnym wyszukiwarkom, algorytm wyszukiwania uwzględnia polskie litery, tworzy linki do wyszukanej strony (lub fragmentu) lub serwera, MetaWizjer kieruje do linku Zobacz czego szukają inni ze spisem haseł, plików i MP3 poszukiwanych przez użytkowników 29
Slide 30
Wyszukiwanie w sieci: Multiwyszukiwarki globalne 1. Meta Crawler: do przeszukiwania wykorzystuje wyszukiwarki i katalogi stron www (m.in.): Google, Ask Jeeves, Fast (AlltheWeb), FindWhat, Overture, LookSmart odrzuca powtarzające się wyniki umożliwia szukanie stron www, plików audio, aukcji, informacji o grupach dyskusyjnych, oferuje podręczny katalog tematyczny 30
Slide 31
Wyszukiwanie w sieci: Multiwyszukiwarki globalne 2. KartOO: korzysta z 14 wyszukiwarek i katalogów wyniki są prezentowane w postaci mapy stron oraz istotnych słów możliwe jest proste i zaawansowane wyszukiwanie wyniki mogą być prezentowane w środowisku Flash oraz html 31
Slide 32
Wyszukiwanie w sieci: Katalogi wyszukiwarek i multiwyszukiwarek 1. Search engines.pl Wszystko o wyszukiwarkach: udostępnia katalog z podziałem na: wyszukiwarki globalne, krajowe, multimedialne multiwyszukiwarki P2P dostępne najświeższe informacje nt. sposobów wyszukiwania w sieci, rankingi narzędzi do wyszukiwania informacji, podstawy języka html 32
Slide 33
Wyszukiwanie w sieci: Katalogi wyszukiwarek i multiwyszukiwarek 2. Wrocławskie Centrum SieciowoSuperkomputerowe. Wyszukiwarki udostępnia opis najpopularniejszych wyszukiwarek i katalogów polskich i światowych w kategoriach: Polska, Portal for search engines, Świat, Serwisy Wszystko w jednym, Poszukiwanie plików, Przeszukiwanie zasobów nowości sieciowych, Wyszukiwarki multimedialne, Darmowe serwisy rejestrujące. 33
Slide 34
Praktyczne rady przy wyszukiwaniu 1. Do szukania informacji w języku polskim, wybieramy polskie wyszukiwarki 2. Jako słowa kluczowe wpisujemy rzeczowniki i dopełnienia 3. W opcji szukaj zawężamy wyszukiwanie 4. Do formułowania wyrażeń złożonych zaleca się używać najwyżej 7 słów w jednym zapytaniu 5. Słowa kluczowe umieszczamy w cudzysłowach 6. Poszukiwania prowadzimy od terminu ogólnego do terminu szczegółowego 7. Używamy odpowiednich do wyszukiwarki operatorów logicznych 8. Przy poszukiwaniu grafiki lub multimediów korzystamy ze specjalizowanych wyszukiwarek 34
Dane:
- Liczba slajdów: 34
- Rozmiar: 0.84 MB
- Ilość pobrań: 403
- Ilość wyświetleń: 10287