Zobacz slidy
Treść prezentacji
Slide 1
Woda środowiskiem procesów życiowych
Slide 2
Woda - życiodajna substancja - bezbarwna, bezwonna, pozbawiona smaku i kalorii jest niezbędna do życia wszystkim organizmom na ziemi. Bez niej nie przetrwałby żaden człowiek, żadne zwierzę, żadna roślina. Potrzebuje jej i słoń, i bakteria; nie można jej niczym zastąpić. Aby być zdrowym, każdy z przeszło pięciu miliardów ludzi musi codziennie przyjąć w posiłkach i napojach około dwóch i pół litra wody. Gdyby jej nie było, nie istniałoby życie. Brak wody uniemożliwia uprawę ziemi i hodowlę zwierząt. Bez wody nie ma żywności, a bez żywności nie ma życia.
Slide 3
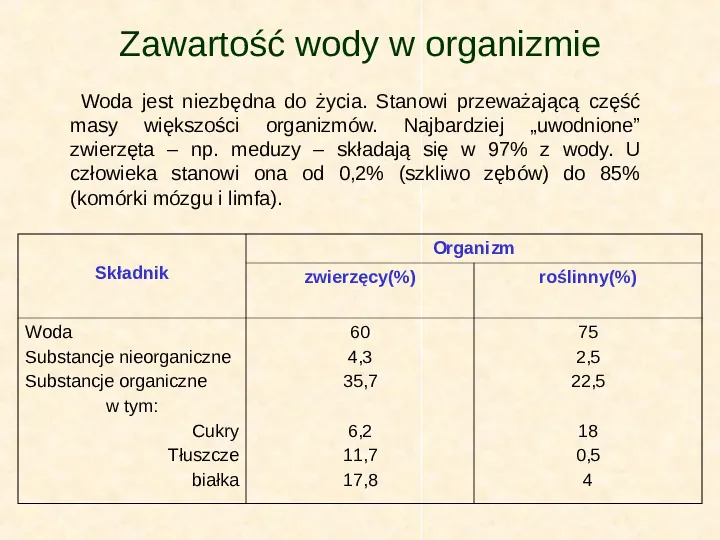
Zawartość wody w organizmie Woda jest niezbędna do życia. Stanowi przeważającą część masy większości organizmów. Najbardziej uwodnione zwierzęta np. meduzy składają się w 97 z wody. U człowieka stanowi ona od 0,2 (szkliwo zębów) do 85 (komórki mózgu i limfa). Organizm Składnik zwierzęcy() roślinny() Woda Substancje nieorganiczne Substancje organiczne w tym: Cukry Tłuszcze białka 60 4,3 35,7 75 2,5 22,5 6,2 11,7 17,8 18 0,5 4
Slide 4
Budowa cząsteczki wody Woda jest cząsteczką o szczególnej budowie i wynikających z niej właściwości. Cząsteczka wody jest zbudowana z jednego atomu tlenu, połączonego dwoma wiązaniami kowalencyjnymi z dwoma atomami wodoru. Umieszczone pod kątem wiązania kowalencyjne mają charakter polarny; ujemny ładunek jest przemieszczony w stronę atomu tlenu, niewielki nadmiar ładunku dodatniego pozostaje na jądrach atomów wodoru. Dzięki niesymetrycznie rozmieszczonym ładunkom elektrycznym, woda ma charakter dipolu. 105
Slide 5
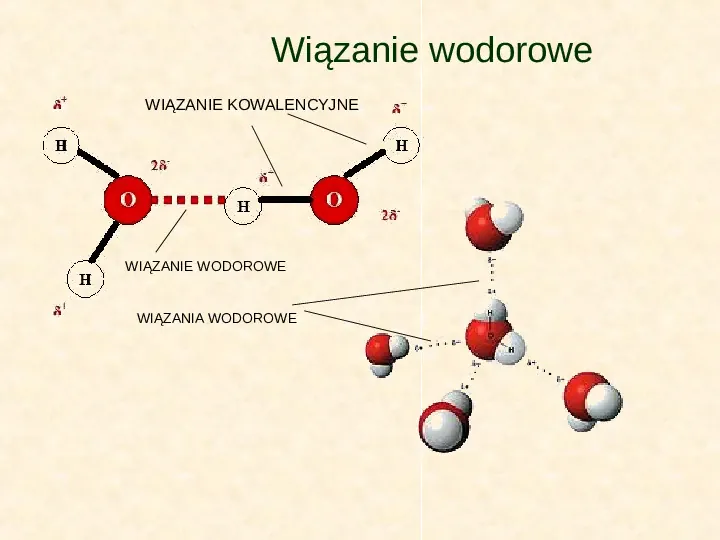
Wiązanie wodorowe W wodzie, zarówno w stanie płynnym, jak i w postaci lodu, cząsteczki połączone są wiązaniami wodorowymi. Jest to słabe oddziaływanie między protonem związanym kowalencyjnie z atomem o dużej elektroujemności i wolną parą elektronową, należącą do atomu silnie elektroujemnego. Cząsteczki wody łatwo tworzą wiązania wodorowe, zarówno między sobą, jak i z innymi cząsteczkami. Każda cząsteczka wody może tworzyć maksymalnie cztery wiązania z innymi cząsteczkami. Tak dzieje się wówczas, gdy woda zamarznie. W kryształach lodu każda cząsteczka wody połączona jest wiązaniami wodorowymi z czterema sąsiadującymi cząsteczkami.
Slide 6
Wiązanie wodorowe WIĄZANIE KOWALENCYJNE WIĄZANIE WODOROWE WIĄZANIA WODOROWE
Slide 7
Trzy stany skupienia wody Przejście wody: ze stanu stałego w ciekły - topnienie ze stanu ciekłego w stały - krzepnięcie ze stanu ciekłego w gazowy - parowanie ze stanu gazowego w ciekły - skraplanie ze stanu stałego w gazowy - sublimacja ze stanu gazowego w stały - resublimacja
Slide 8
Właściwości wody temperatura topnienia pod ciśnieniem 1 atm: 0C 273,15 K temperatura wrzenia pod ciśnieniem 1 atm: 100C 373,15 K odznacza się wysokim ciepłem właściwym ma wysokie ciepło parowania osiąga największą gęstość w temperaturze 4C wykazuje wysokie napięcie powierzchniowe wykazuje dość dużą lepkość wykazuje również dużą wartość stałej dielektrycznej (w t0C ma ona wartość 87,9, a w t25C 78,4). To dzięki tak dużej wartości tej stałej woda jest rozpuszczalnikiem tylu substancji jonowych, wywołując ich dysocjację.
Slide 9
Woda odznacza się wysokim ciepłem właściwym Oznacza to, że aby podnieść temperaturę wody o 1C potrzebna jest znaczna ilość energii. Aby podnieść jej temperaturę należy dostarczyć energii cieplnej, która spowoduje, że cząsteczki wody zaczną poruszać się szybciej, zwiększą swoją energię kinetyczną. Z kolei większa swoboda ruchu cząsteczek oznacza konieczność zerwania części utrzymujących je razem wiązań wodorowych. Energia, która zostaje dostarczona do układu w większości zużyta zostaje na zerwanie wiązań, tylko niewielka część wykorzystywana jest do podniesienia temperatury wody, czyli do zwiększenia prędkości jej cząsteczek. Przemianie wody w lód, czyli procesowi odwrotnemu towarzyszy uwolnienie energii do środowiska.
Slide 10
Woda odznacza się wysokim ciepłem właściwym Dzięki temu, że do obniżenia lub podniesienia temperatury wody niezbędna jest duża utrata lub wkład energii cieplnej, dlatego wielkie zbiorniki wodne mają względnie stałą temperaturę, a żyjące tam organizmy mają zapewnioną stosunkowo stałą temperaturę środowiska. Wysoka zawartość wody w organizmach żywych pomaga im także w utrzymaniu stałej temperatury wewnętrznej, co ma znaczenie dla wszystkich reakcji biologicznych, gdyż mogą one odbywać się w niewielkim zakresie temperatur.
Slide 11
Woda ma wysokie ciepło parowania Również ze względu na obecność wiązań wodorowych woda ma wysokie ciepło parowania. W trakcie przemiany cieczy w gaz woda pochłania ciepło, z tego też względu ciało ludzkie może pozbywać się nadmiaru ciepła przez parowanie potu na powierzchni skóry. Podobnie liść wystawiony na silne promieniowanie słoneczne obniża temperaturę tkanek dzięki wyparowywaniu wody przez szparki (transpiracja).
Slide 12
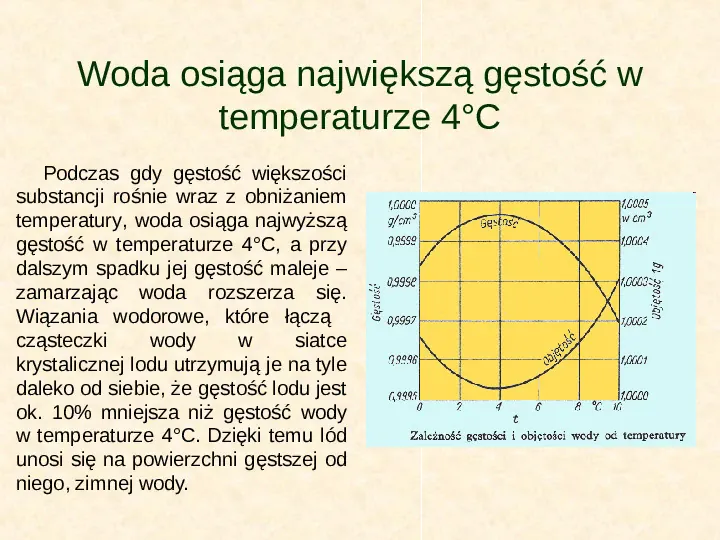
Woda osiąga największą gęstość w temperaturze 4C Podczas gdy gęstość większości substancji rośnie wraz z obniżaniem temperatury, woda osiąga najwyższą gęstość w temperaturze 4C, a przy dalszym spadku jej gęstość maleje zamarzając woda rozszerza się. Wiązania wodorowe, które łączą cząsteczki wody w siatce krystalicznej lodu utrzymują je na tyle daleko od siebie, że gęstość lodu jest ok. 10 mniejsza niż gęstość wody w temperaturze 4C. Dzięki temu lód unosi się na powierzchni gęstszej od niego, zimnej wody.
Slide 13
Woda osiąga największą gęstość w temperaturze 4C Po ogrzaniu lodu do temperatury wyższej niż 0C wiązania wodorowe pękają, dzięki czemu cząsteczki mogą bardziej zbliżyć się do siebie. Maksymalna gęstość wody występuje w temperaturze 4C. Powyżej tej temperatury, wraz ze wzrostem prędkości cząsteczek woda zaczyna się rozszerzać. Powyżej opisana właściwość ma ogromne znaczenie. Gdyby lód miał większą gęstość niż woda, tonąłby i w rezultacie wszystkie zbiorniki wodne byłyby zamarznięte, a to z kolei uniemożliwiałoby życie. Warstwa lodu, która pokrywa zbiornik, gdy ten się ochładza, izoluje ciekłą wodę pod spodem, chroni ją przed zamarznięciem, a tym samym umożliwia przetrwanie życia.
Slide 14
ZBIORNIK WODY LATEM ZBIORNIK WODY ZIMĄ
Slide 15
W wodzie występują siły kohezji i adhezji Tendencja cząsteczek wody do skupiania się, czyli kohezji, jest skutkiem tworzenia się między nimi wiązań wodorowych. Cząsteczki wody przylegają również do do tych substancji, na powierzchni których występują grupy naładowanych atomów lub cząsteczek. Działające w tym przypadku siły adhezji wyjaśniają zjawisko zwilżania przez wodę różnych powierzchni, np. drewna czy ubrań uszytych z naturalnych włókien. Cząsteczki obecne w drewnie, wełnie, jedwabiu czy bawełnie mają charakter polarny wiele atomów, które znajdują się w tych cząsteczkach może tworzyć wiązania wodorowe z cząsteczkami wody. Woda nie zwilża natomiast powierzchni tłustych, pokrytych parafiną czy woskiem niewiele jest w nich atomów, które mogą tworzyć wiązania wodorowe z cząsteczkami wody. Kohezja między cząsteczkami wody jest przyczyną wysokiego napięcia powierzchniowego wody.
Slide 16
Woda wykazuje wysokie napięcie powierzchniowe Nartnik Oznacza to, że siły, które skupiają cząsteczki wody są większe niż siły działające między jej cząsteczkami a cząsteczkami gazów znajdujących się w powietrzu. Cząsteczki wody tworzą oddziaływania z cząsteczkami znajdującymi się na zwilżanej powierzchni. W efekcie, gdy woda znajdzie się w cienkiej kapilarze, siły, które powstają na skutek tych oddziaływań wypychają ją do góry, często na znaczną odległość. Te same siły pozwalają zachować ciągłość słupa wody w cienkich kapilarach naczyń transportujących wodę w roślinie. Błona powierzchniowa, która tworzy się na wolnej wody, na skutek działania sił międzycząsteczkowych, jest na tyle zwarta, że wytrzymuje znaczny ciężar leżących na niej przedmiotów. Dzięki jej obecności mogą poruszać się po powierzchni wody niektóre owady, np. nartnik czy drobne ślimaki.
Slide 17
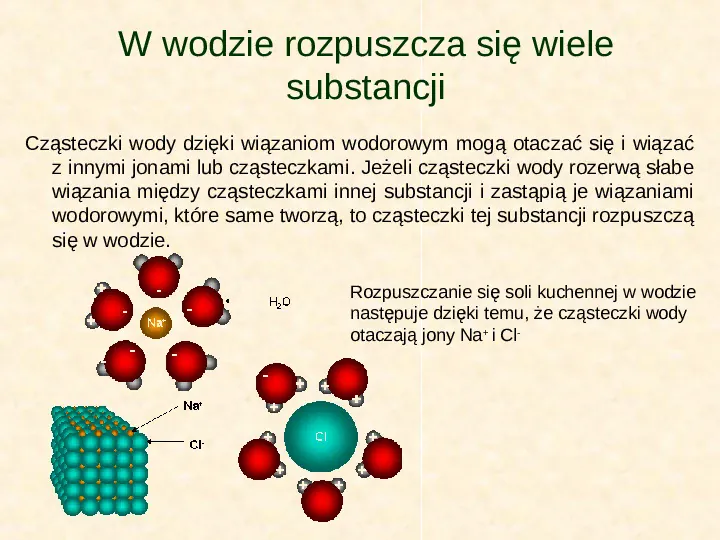
W wodzie rozpuszcza się wiele substancji Cząsteczki wody dzięki wiązaniom wodorowym mogą otaczać się i wiązać z innymi jonami lub cząsteczkami. Jeżeli cząsteczki wody rozerwą słabe wiązania między cząsteczkami innej substancji i zastąpią je wiązaniami wodorowymi, które same tworzą, to cząsteczki tej substancji rozpuszczą się w wodzie. Rozpuszczanie się soli kuchennej w wodzie następuje dzięki temu, że cząsteczki wody otaczają jony Na i Cl-
Slide 18
Woda ma dość dużą lepkość Stosunkowo duża lepkość wody powodowana jest polarną budową jej cząsteczek. Sprawia ona, że organizmy biernie poruszające się w wodzie często wytwarzają wiele urządzeń ułatwiających utrzymanie się w toni wodnej i chroniących przed opadaniem na dno, np. pęcherzyki powietrza, krople tłuszczu. Zwierzęta czynnie poruszające się w wodzie często przyjmują opływowe kształty oraz mają ciało pokryte warstwą śluzu, co zmniejsza tarcie i ułatwia poruszanie się.
Slide 19
Rola wody jest rozpuszczalnikiem, w którym zachodzi większość reakcji biologicznych jest substratem wielu przemian biochemicznych, np. podczas trawienia składników pokarmowych jest produktem wielu reakcji, np. oddychania wewnątrzkomórkowego stanowi środek transportu wewnątrzustrojowego: np. produktów przemiany materii, substancji odżywczych, hormonów, enzymów reguluje temperaturę jest środowiskiem życia wielu organizmów
Slide 20
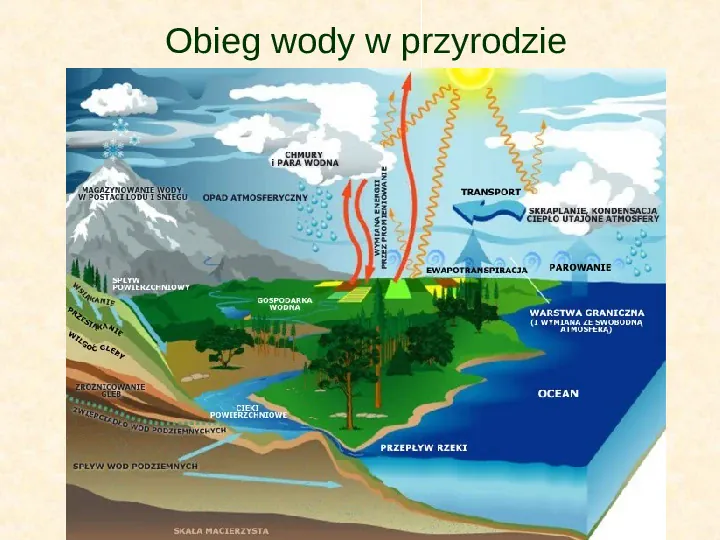
Obieg wody w przyrodzie
Slide 21
Obieg wody w przyrodzie Pod wpływem ciepła słonecznego powierzchnia mórz i oceanów nieustannie paruje. Woda zmienia stan skupienia i masy pary wodnej mieszają się z powietrzem. Przy dostatecznie dużej wilgotności powietrza następuje skraplanie pary wodnej do postaci małych kropelek, które grupują się w widoczne skupienia - chmury. W wyniku ochładzania na niewielkich wysokościach powietrza zawierającego parę wodną powstają mgły. Chmury, niesione wiatrem przemieszczają się nad powierzchnią lądów mórz i oceanów. W określonych warunkach drobniutkie kropelki łączą się ze sobą w większe krople i opadają na ziemię jako deszcz, śnieg lub grad. Ziemia wchłania opady atmosferyczne i gromadzi je w postaci wód gruntowych. W niektórych miejscach wody gruntowe wydostają się na powierzchnię i tak powstają źródła. Z nich biorą początek strumyki, te z kolei łączą się ze sobą w większe strumienie i rzeki, które wpadają do morza lub oceanu. W ten sposób zamyka się obieg wody w przyrodzie.
Slide 22
Literatura: Danowski J.,2005. Repetytorium dla maturzystów i kandydatów na uczelnie medyczne. Tom 1. Medyk, Warszawa Villee i inni, 1996. Biologia. Multico, Warszawa Wiśniewski H, 1998. Biologia. Agmen, Warszawa Pyłka Gutowska E., 1995. Vademecum maturzysty. Biologia. Oświata, Warszawa http:www.woda.ovh.orgindex.htm http:www.fizyka.net.pl
Dane:
- Liczba slajdów: 22
- Rozmiar: 7.75 MB
- Ilość pobrań: 85
- Ilość wyświetleń: 6830