Zobacz slidy
Treść prezentacji
Slide 1
Szereg napięciowy metali
Slide 2
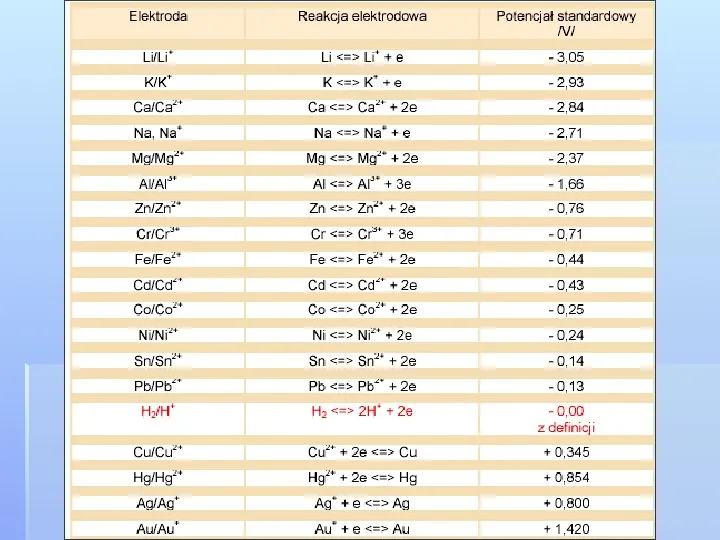
Szereg napięciowy metali (inaczej szereg elektrochemiczny, szereg aktywności metali) to zestawienie pierwiastków chemicznych o własnościach metalicznych, według ich potencjału standardowego E0. Punktem odniesienia dla tego zestawienia jest elektroda wodorowa, której potencjał standardowy przyjmuje się umownie za zero.
Slide 3
Kawałek metalu, włożony do roztworu zawierającego jony innego metalu, może rozpuszczać się, powodując wydzielanie tego drugiego metalu z roztworu. Tak więc blaszka cynkowa umieszczona w roztworze soli miedziowej powoduje odkładanie się warstwy metalicznej miedzi w miarę, jak cynk przechodzi do roztworu.
Slide 4
Blaszka miedziana umieszczona w roztworze soli cynkowej nie powoduje wydzielania się metalicznego cynku. W pierwszym przypadku mamy do czynienia z reakcją utleniania i redukcji w czasie której cynk przechodzi do roztworu a miedź wytrąca się w postaci osadu, którym jest metaliczna miedź. W tym przypadku możemy napisać, że cynk posiada zdolność redukowania jonów miedzi Cu2 zgodnie z równaniem. Zn (s) Cu2(aq) Zn2(aq) Cu (s)
Slide 6
Przedstawiona tabela ma swoje praktyczne znaczenie. A mianowicie wartość potencjału standardowego jest miarą zdolności utleniającoredukujących pary utleniaczreduktor. Znak i wartość potencjału standardowego określają zdolności redukujące cząstek. Z dodatniego znaku Eo(Cu2Cu), 0,34 V, wynika, że warunkach standardowych w ogniwie z elektrodą wodorową miedź jest katodą, czyli miejscem redukcji. To oznacza, że w warunkach standardowych miedź jest redukowana przez gazowy wodór: Cu2aq H2(g) Cu(s) 2H(aq)
Slide 7
Przeciwnie natomiast ujemny znak Eo(Zn2aq Zn), 0,76 V, wskazuje, że w warunkach standardowych w ogniwie z elektrodą wodorową cynk jest anodą, miejscem utleniania. Oznacza to, że warunkach standardowych cynk redukuje jony wodorowe do gazowego wodoru: Zn(s) 2H(aq) Zn2aq H2(g)
Slide 8
Potencjał reakcji połówkowej jest miarą zdolności do zajścia tej reakcji połówkowej, niezależnie od tego, jaka jest druga reakcja połówkowa reakcji sumarycznej. Potencjał sumaryczny można obliczyć, sumując potencjały reakcji połówkowych. Tak otrzymany potencjał jest miarą zdolności do zajścia reakcji i jest napięciem zmierzonym w ogniwie, w którym reakcja ta zachodzi.
Slide 9
Wnioski wynikające z szeregu napięciowego metali Każdy metal o niższym potencjale normalnym wypiera z roztworu soli metal o wyższym potencjale. Poza litowcami i berylowcami. Metale o ujemnych potencjałach normalnych mogą wypierać wodór. Metale te są metalami aktywnymi, nazywane czasami nieszlachetnymi. Zn HCl ZnCl2 H2 Reakcja przebiega tym mniej energicznie, im bliższy zera jest potencjał normalny metali.
Slide 10
Metale o dodatnich potencjałach normalnych nie wypierają wodoru z kwasów. Metale te nazywane są metalami szlachetnymi. Im bardziej dodatni potencjał normalny metalu, tym większa jest jego zdolność do redukcji. Im bardziej ujemny potencjał normalny metalu, tym większa jest jego zdolność do ulegania reakcji utlenienia.
Slide 11
Kierunek reakcji redoks Każda reakcja redoks, której całkowity potencjał jest dodatni, może zachodzić samorzutnie zgodnie z zapisem równania. Można to stwierdzić na podstawie względnego położenia reakcji połówkowych. Każdy utleniacz reaguje samorzutnie z dowolnym reduktorem położonym poniżej tego utleniacza. I tak I2 reaguje z Cu, H2, Fe, ale nie utlenia BR, H2O, Cl, itd.
Slide 12
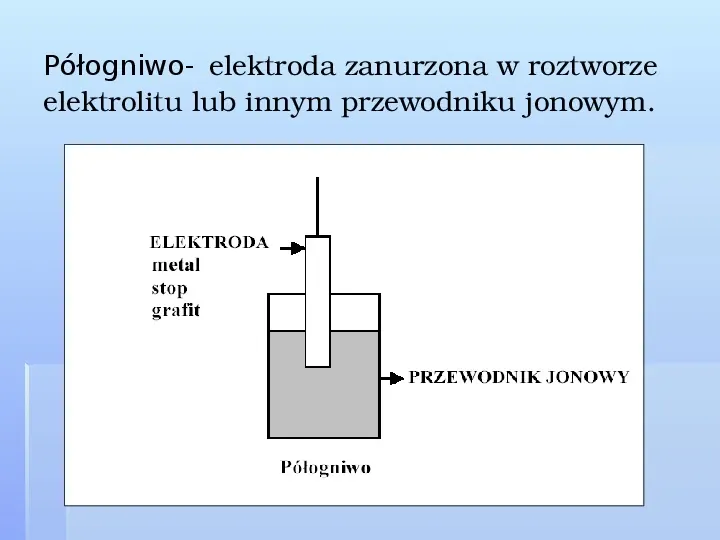
Półogniwo- elektroda zanurzona w roztworze elektrolitu lub innym przewodniku jonowym.
Slide 13
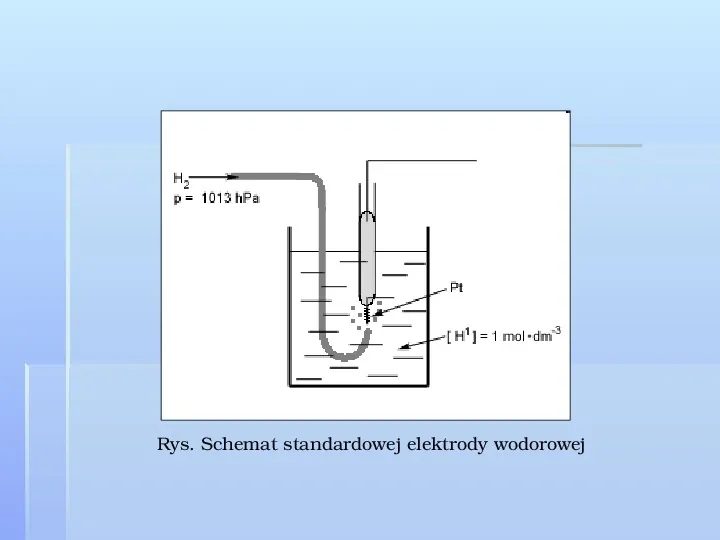
Standardowa elektroda wodorowa Rys. Elektroda wodorowa Standardowa elektroda wodorowa składa się z płytki platynowej pokrytej warstewką czerni platynowej, która posiada właściwość absorbowania gazowego wodoru. Nasycona gazowym wodorem płytka platynowa nie bierze bezpośredniego udziału w reakcji elektrodowej, ale zachowuje się tak, jakby była elektrodą wykonaną z samego wodoru.
Slide 14
Płytka ta zanurzona jest w roztworze mocnego kwasu o jednostkowej aktywności jonów wodorowych. Cząsteczki wodoru z płytki platynowej podobnie jak metale przechodzą w postaci jonów do roztworu a jednocześnie jony wodorowe z roztworu ulegają na płytce platynowej rozładowaniu H2 2H 2e Potencjał elektrodowy takiej właśnie elektrody wodorowej przyjęto za równy zeru.
Slide 15
Rys. Schemat standardowej elektrody wodorowej
Slide 16
Potencjał standardowy Potencjał standardowy, standardowy potencjał półogniwa, E siła elektromotoryczna ogniwa zbudowanego z ogniwa badanego, zawierającego jony o jednostkowej aktywności, oraz elektrody wodorowej, której potencjał przyjmuje się za równy 0 we wszystkich temperaturach, aby było możliwe określenie potencjału badanej elektrody (lewa strona na schematach). Jeśli badana elektroda jest anodą, to jej potencjał jest ujemny, jeśli natomiast jest katodą to jej potencjał jest dodatni. Potencjał standardowy rozumiany jest również jako wkład elektrody do standardowej siły elektromotorycznej ogniwa.
Slide 17
W ogniwie galwanicznym siła elektromotoryczna ogniwa jest różnicą standardowych potencjałów elektrod, obliczaną ze wzoru: E potencjał ogniwa Ekatoda potencjał katody Eanoda potencjał anody
Slide 18
Dziękuję za uwagę
Dane:
- Liczba slajdów: 18
- Rozmiar: 1.01 MB
- Ilość pobrań: 298
- Ilość wyświetleń: 21778