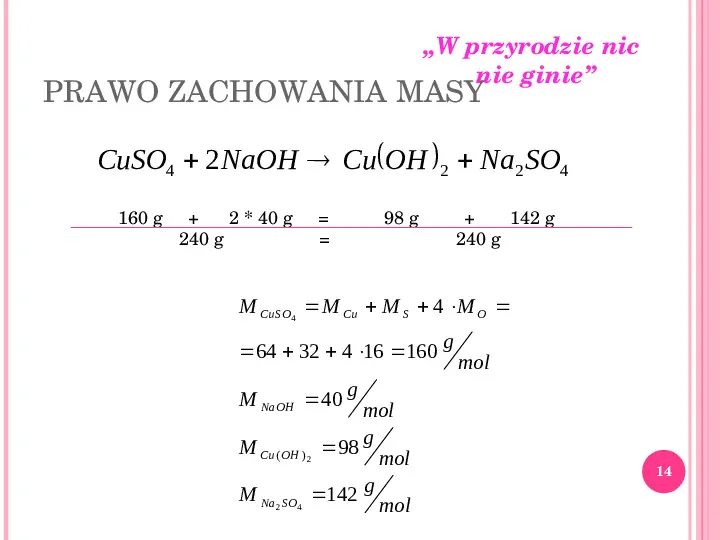Zobacz slidy
Treść prezentacji
Slide 1
PODSTAWY OBLICZEŃ CHEMICZNYCH 1 mgr inż. Joanna Sławna
Slide 2
CHEMIA JEST NAUKĄ EKSPERYMENTALNĄ! 2
Slide 3
CO TO JEST MOL? Jednostka liczności materii Tuzin 12 sztuk Mol 6,02 1023 sztuk takich samych elementów budowy materii (atomów, cząsteczek, jonów, elektronów) Definicja: MOL jest to zbiór N takich samych elementów budowy materii. Liczbę 6,02 1023 (czyli liczbę elementów wchodzących w skład jednego mola) wyznaczył włoski fizyk Amadeo Avogadro. Liczbę tę oznaczamy literą N i nazywamy liczbą Avogadra 3
Slide 4
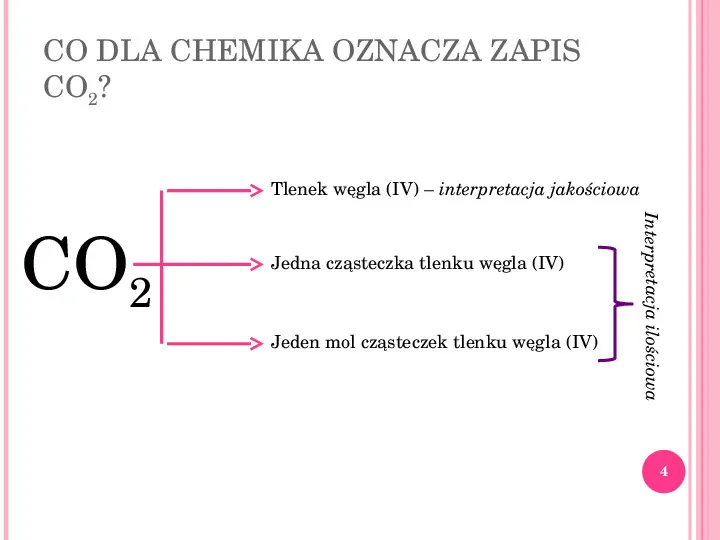
CO DLA CHEMIKA OZNACZA ZAPIS CO2? Tlenek węgla (IV) interpretacja jakościowa Jeden mol cząsteczek tlenku węgla (IV) Interpretacja ilościowa CO2 Jedna cząsteczka tlenku węgla (IV) 4
Slide 5
A CO NAM MÓWI RÓWNANIE REAKCJI? H 2O CO2 H 2CO3 Interpretacja jakościowa: woda reaguje z tlenkiem węgla (IV) tworząc kwas węglowy Interpretacja cząsteczkowa: jedna cząsteczka wody reaguje z jedną cząsteczką tlenku węgla (IV) tworząc jedną cząsteczkę kwasu węglowego Interpretacja molowa: jeden mol cząsteczek wody reaguje z jednym molem cząsteczek tlenku węgla (IV) tworząc jeden mol cząsteczek kwasu węglowego (IV) 5
Slide 6
ZADANIA: 6
Slide 7
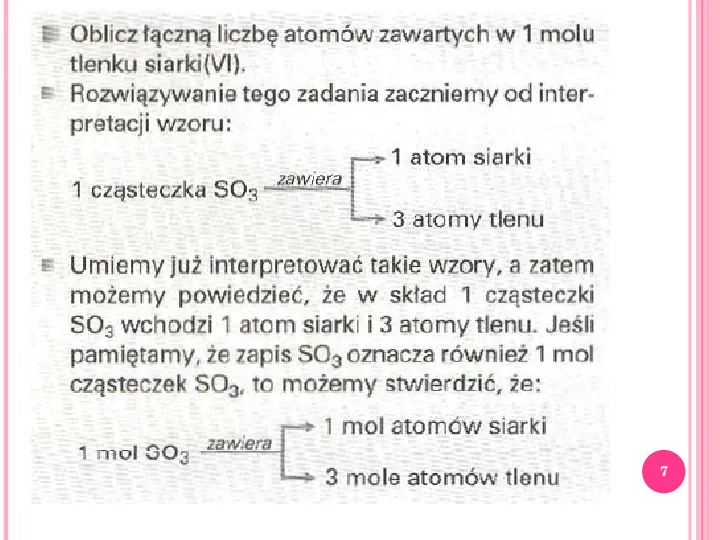
7
Slide 8
8
Slide 9
ZADANIA: 9
Slide 10
MASA MOLOWA To masa 1 mola danej substancji g M mol Liczbowo masa molowa atomu (cząsteczki) danego pierwiastka jest równa jego masie atomowej (cząsteczkowej) 10
Slide 11
ZADANIA: 11
Slide 12
12
Slide 13
1. Oblicz masy molowe kwasu siarkowego (VI) i kwasu fosforowego (V). 2. W naczyniu znajdują się 72 g wody. Oblicz ile cząsteczek wody znajduje się w tym naczyniu. 3. Oblicz, ile atomów siarki znajduje się w 9,8 g kwasu siarkowego (VI). 4. Oblicz łączną liczbę atomów stanowiących 8,8 g tlenku węgla (IV). 13
Slide 14
W przyrodzie nic nie ginie PRAWO ZACHOWANIA MASY CuSO4 2 NaOH Cu OH 2 Na2 SO4 160 g 2 40 g 240 g 98 g 142 g 240 g M CuSO4 M Cu M S 4 M O 64 32 4 16 160 g mol M NaOH 40 g mol M Cu ( OH ) 2 98 g mol M Na 2 SO4 142 g mol 14
Slide 15
PRAWO ZACHOWANIA MASY Łączna masa wszystkich substratów reakcji chemicznej jest równa łącznej masie wszystkich produktów powstających w wyniku tej reakcji. 15
Slide 16
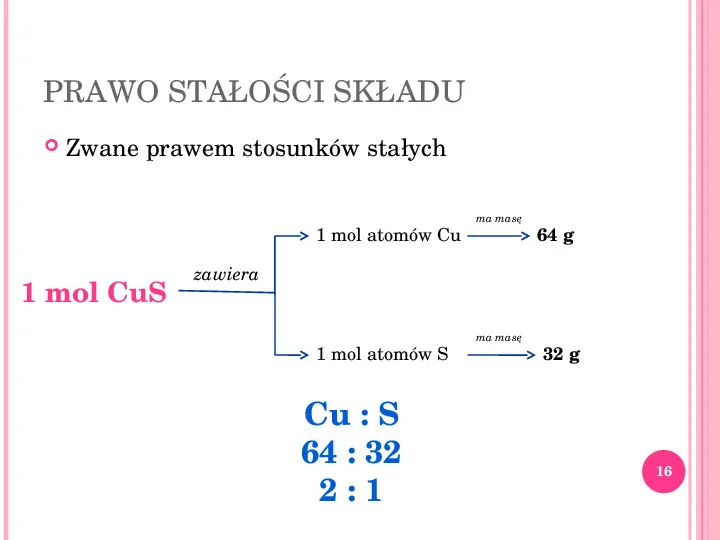
PRAWO STAŁOŚCI SKŁADU Zwane prawem stosunków stałych 1 mol atomów Cu 1 mol CuS ma masę 64 g zawiera 1 mol atomów S Cu : S 64 : 32 2:1 ma masę 32 g 16
Slide 17
PRAWO STAŁOŚCI SKŁADU Jeżeli pierwiastki łączą się w określony związek chemiczny, to zawsze na ściśle określoną liczbę gramów jednego pierwiastka przypada ściśle określona liczba gramów pozostałych pierwiastków, co oznacza, że skład chemiczny danego związku jest zawsze stały. 17
Slide 18
ZADANIA: 1. Określ stosunek masowy żelaza do siarki w siarczku żelaza (II). 2. Do syntezy siarczku żelaza (II) odważono 56 g żelaza i 28 g siarki. Czy podczas tej reakcji oba pierwiastki przereagują w całości? 3. Ustal wzór elementarny związku węgla z tlenem, w którym stosunek masowy węgla do tlenu wynosi 3:8. 18
Slide 19
19
Slide 20
Warunki normalne: Ciśnienie: 1013 hPa Temperatura: 273 K (0OC) PRAWA GAZOWE m V gęstość Objętość molowa to objętość jaką zajmuje 1 mol gazu doskonałego w warunkach normalnych. Vmol M Objętość molowa 20
Slide 21
OBJĘTOŚĆ MOLOWA 21
Slide 22
OBJĘTOŚĆ MOLOWA 22
Slide 23
OBJĘTOŚĆ MOLOWA Wykonując analogiczne obliczenia dla innych gazów rzeczywistych, otrzymalibyśmy zawsze podobny wynik. Zaniedbując niewielkie różnice możemy stwierdzić, że: 1 mol dowolnego gazu w warunkach normalnych zajmuje stałą objętość 22,4 dm3 Vmol 22,4 dm 3 mol 23
Slide 24
24
Slide 25
PRAWO AVOGADRA Jednakowe objętości różnych gazów, w tych samych warunkach ciśnienia i temperatury, składają się z jednakowej liczby cząsteczek. 25
Slide 26
PRAWO GAY-LUSSACA N 2 3H 2 2 NH 3 1 mol 3 mole 2 mole 22,4 dm3 67,2 dm3 1 : 3 44,8 dm3 : 2 Objętości reagujących ze sobą gazów oraz gazowych produktów ich reakcji odmierzone w tych samych warunkach ciśnienia i temperatury pozostają do siebie w stosunku niewielkich liczb całkowitych. 26
Slide 27
ZADANIA: 27
Slide 28
OBLICZENIA STECHIOMETRYCZNE W PRAKTYCE ZADANIA! 28
Slide 29
29
Slide 30
30
Slide 31
31
Slide 32
32
Slide 33
ZADANIA: 1. Oblicz, ile gramów tlenu znajduje się w 3,5 molach siarczanu (VI) glinu. 2. Oblicz, ile: a) moli b) gramów c) cząsteczek d) dm3 (warunki normalne) wodoru wydzieli się w reakcji 7,2 g magnezu z kwasem fosforowym (V) 3. Oblicz gęstość siarkowodoru (warunki normalne). 33
Slide 34
4. Przeprowadzono reakcję magnezu z kwasem solnym. W tym celu użyto kolejno: a) 4,8 g magnezu b) 0,2 mola magnezu c) 12.041022 atomów magnezu W którym wypadku otrzymano największą objętość wodoru? 5. Oblicz liczbę cząsteczek i atomów składających się na 8 g tlenu. 6. Ustal wzór związku zawierającego 2,4 wodoru, 39,1 siarki i 58,5 34
Slide 35
POWINIENEŚ: znać podstawowe pojęcia chemiczne (mol, masa molowa, objętość molowa) znać prawa chemiczne (prawo zachowania masy, prawo stałości składu, prawo Avogadra i Gay-Lussaca) umieć stosować pojęcia i prawa chemiczne do rozwiązywania zadań rachunkowych 35
Dane:
- Liczba slajdów: 35
- Rozmiar: 9.44 MB
- Ilość pobrań: 118
- Ilość wyświetleń: 6360