Zobacz slidy
Treść prezentacji
Slide 1
ATOMY Joanna Kowalczyk
Slide 2
Modele budowy atomu
Slide 3
1896 odkrycie promieniotwórczości naturalnej, Henri Becquerel. Badania nad promieniotwórczością naturalną Maria SkłodowskaCurie, Piotr Curie Próby wyjaśnienia zjawiska fotoelektrycznego, polegającego na wybijaniu elektronów z metalu w wyniku oświetlania jego powierzchni 1897 - odkrycie elektronu, Joseph Thomson 1906 atom: dodatnio naładowana materia z ujemnymi rodzynkami elektronami, J. Thomson 1911 planetarny model atomu, wielkość jądra i elektronów znikomo mała w porównaniu z atomem, Ernest Rutherford 1913 teoria orbit stacjonarnych, Niels Bohr 1886 odkrycie protonów, Eugen Goldstein, Wilhelm Wien 1924 dwoista natura elektronów, de Broglie 1932 odkrycie neutronów, James Chadwick Historia
Slide 4
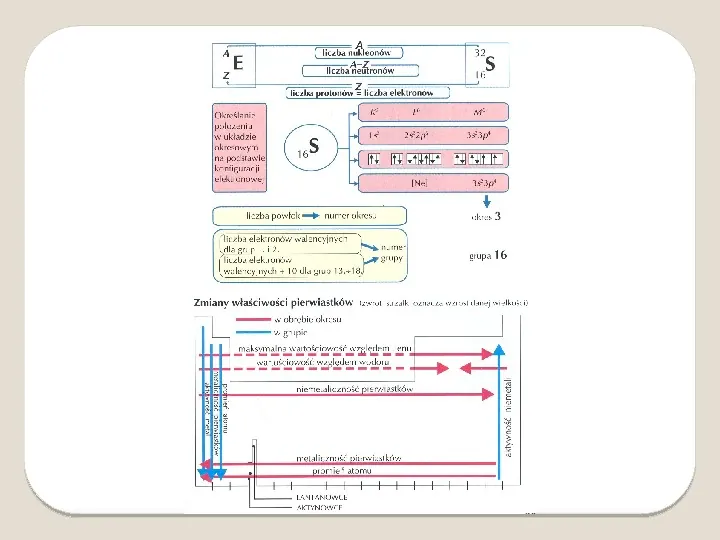
W latach trzydziestych XX wieku ustalono, że atomy są strukturami złożonymi. Wyodrębniono trzy podstawowe elementy składowe atomów. Tworzące jądro protony i neutrony nazywane są nukleonami. Atomy są obojętne elektrycznie więc liczba ładunków dodatnich (protonów) jest identyczna jak liczba ładunków ujemnych (elektronów). Liczba masowa (A) jest wartością opisującą liczbę nukleonów w jądrze atomu. Liczba atomowa (Z) określa, ile protonów znajduje się w jądrze danego atomu. Jest także równa liczbie elektronów niezjonizowanego atomu. Cząstki elementarne w atomie
Slide 5
Izotopy są to atomy tego samego pierwiastka, różniące się liczbą neutronów w jądrze. Izotopy wodoru
Slide 6
Jest to zjawisko przekształcania się nietrwałych nuklidów (zbiór identycznych atomów ) w inne nuklidy w wyniku rozpadu jąder atomowych. Rodzaje promieniowania jądrowego: alfa- dwudodatnie jądra helu beta elektrony gamma promieniowanie o dużej przenikliwości fal Izotopy promieniotwórcze znalazły szerokie zastosowanie w różnych dziedzinach naszego życia: Medycyna niszczenie tkanki nowotworowej Przemysł elektryczny - elektrownie jądrowe Hutnictwo określanie strukturalnych defektów odlewów Badania naukowe ustalanie mechanizmów reakcji chemicznych Badania rozpuszczalności Promieniotwórczość naturalna
Slide 7
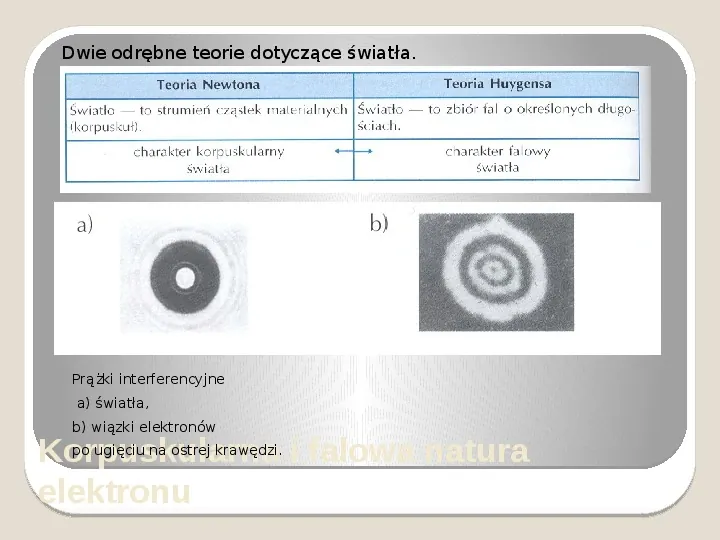
Dwie odrębne teorie dotyczące światła. Prążki interferencyjne a) światła, b) wiązki elektronów po ugięciu na ostrej krawędzi. i falowa natura Korpuskularna elektronu
Slide 8
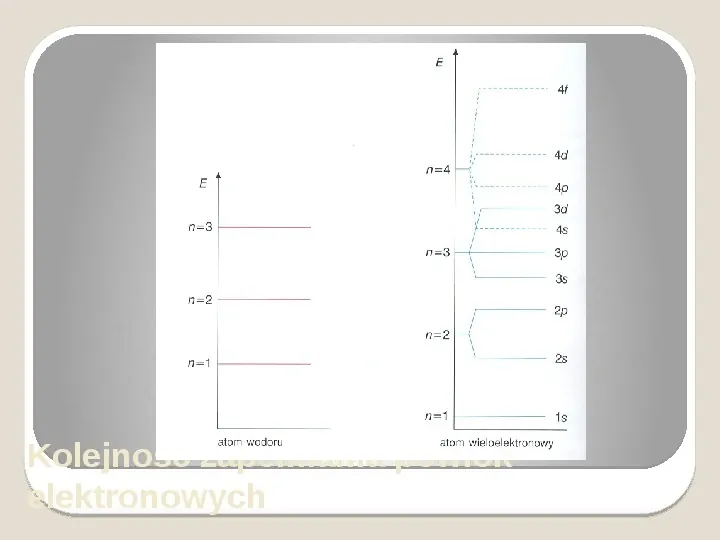
Kolejność zapełniania powłok elektronowych
Slide 9
Reguła mówiąca, że w atomie, w celu uzyskania najbardziej korzystnego energetycznie zapełnienia orbitali atomowych, powinno być jak najwięcej elektronów niesparowanych. Elektrony ulegają sparowaniu po pojedynczym zapełnieniu wszystkich form przestrzennych danych orbitali danej powłoki elektronowej. Kolejność wypełniania podpowłok - reguły Hunda: Zapełnione powłoki nie wnoszą wkładu do L (całkowity orbitalny moment pędu) i S (całkowity spinowy moment magnetyczny). W stanie podstawowym elektrony o tej samej wartości l są rozmieszczane tak, żeby wypadkowy spin S był maksymalny. Stany o wyższej multipletowości mają więc niższe energie. Po uwzględnieniu energii LS najniższe energie mają: Termy o najmniejszych wartościach J dla podpowłok zapełnionych mniej niż w połowie, Termy o największych wartościach J dla podpowłok zapełnionych więcej niż w połowie (zmienia się znak pola magnetycznego działającego na elektron). Reguła Hunda
Slide 18
KRÓTKA BIBLIOGRAFIA: www.wikipedia.pl www.google.pl www.youtube.com Chemia ogólna i nieorganiczna Bożena Kałuża, Feliksa Kamińska
Dane:
- Liczba slajdów: 18
- Rozmiar: 6.54 MB
- Ilość pobrań: 3433
- Ilość wyświetleń: 24431