Zobacz slidy
Treść prezentacji
Slide 1
Wiązania chemiczne Mgr inż. Joanna Sławna 1
Slide 2
Reguła dubletu i oktetu Elektronowa teoria wiązań teoria Lewisa i Kossela U podstaw teorii leży fakt, że gazy szlachetne, które mają całkowicie zapełnioną elektronami powłokę walencyjną są chemicznie bierne Ośmioelektronowa konfiguracja powłoki walencyjnej (lub dwuelektronowa dla helu) jest szczególnie trwała Atomy tworzące związek chemiczny będą dążyły do konfiguracji idealnej czyli konfiguracji najbliższego gazu szlachetnego, aby osiągnąć największą stabilność (trwałość) 2
Slide 3
Reguła oktetu i dubletu Najbardziej stabilna jest konfiguracja: 2 elektrony dublet (He) reguła dubletu 8 elektronów oktet (Ne, Ar, Kr, Xe, Rn) reguła oktetu Różne sposoby osiągnięcia trwałej konfiguracji: Oddanie elektronów Tworzenie jonów Przyjęcie elektronów 3
Slide 4
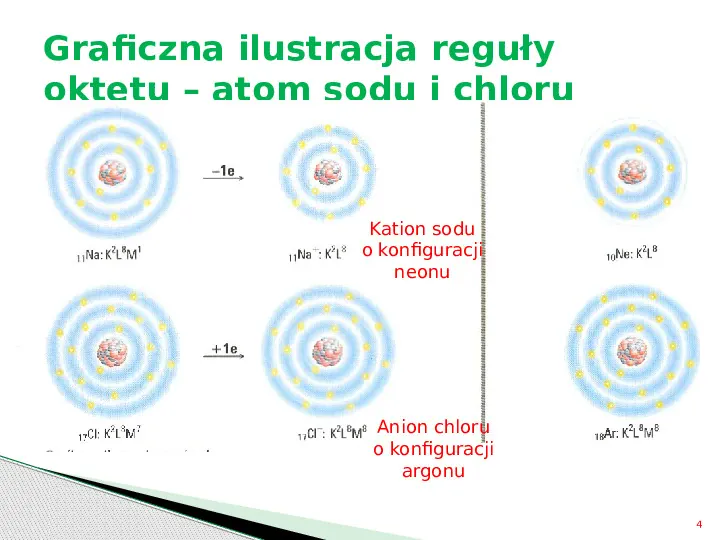
Graficzna ilustracja reguły oktetu atom sodu i chloru Kation sodu o konfiguracji neonu Anion chloru o konfiguracji argonu 4
Slide 5
Podsumowanie: Atomy niektórych pierwiastków oddają lub przyjmują elektrony, uzyskując trwałą konfigurację elektronową najbliższego gazu szlachetnego. Oddawanie lub przyjmowanie elektronów powoduje utworzenie jonów dodatnich (kationów) lub ujemnych (anionów). 5
Slide 6
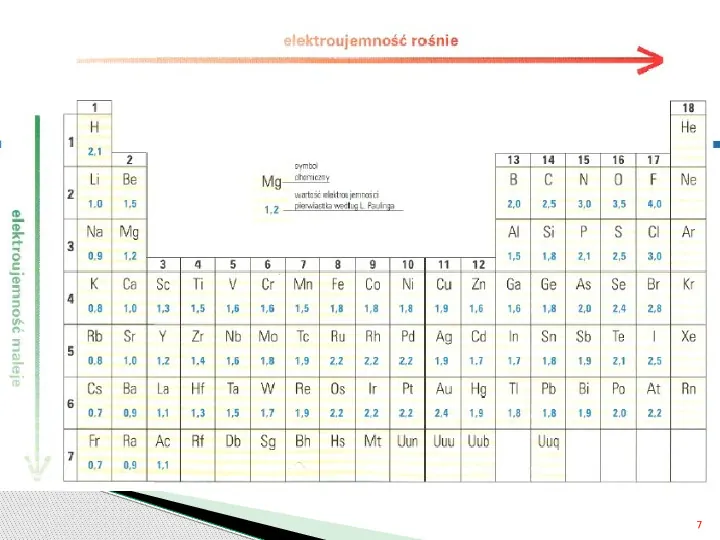
Elektroujemność Linus Pauling podzielił pierwiastki w układzie okresowym na elektroujemne i elektrododatnie Pierwiastki elektroujemne chętnie przyjmują elektrony Pierwiastki elektrododatnie chętnie oddają elektrony ELEKTOUJEMNOŚĆ to zdolność atomu do przyciągania elektronów Elektoujemność to miłość atomów do elektronów prof. Rajmund Sołoniewicz http:diet.comgpauling-linus 6
Slide 7
7
Slide 8
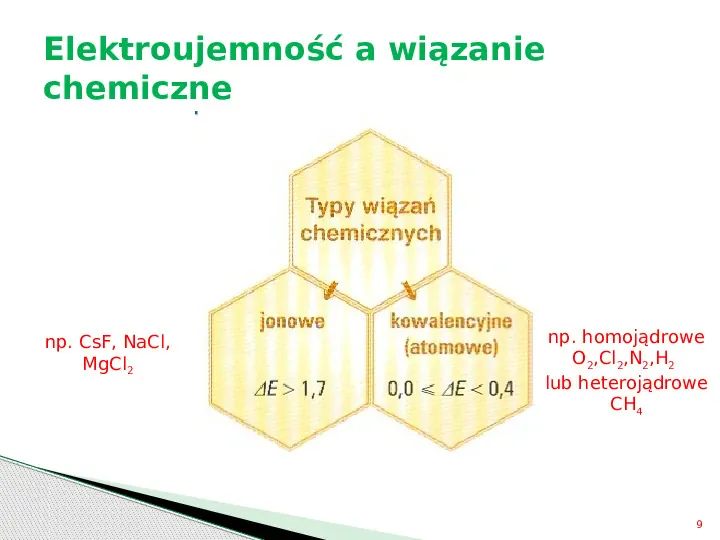
Typy wiązań chemicznych Wiązanie jonowe pobieranie lub oddawanie elektronów, tworzenie jonów, oddziaływania elektrostatyczne Wiązanie kowalencyjne (atomowe) uwspólnianie elektronów 8
Slide 9
Elektroujemność a wiązanie chemiczne np. CsF, NaCl, MgCl2 np. homojądrowe O2,Cl2,N2,H2 lub heterojądrowe CH4 9
Slide 10
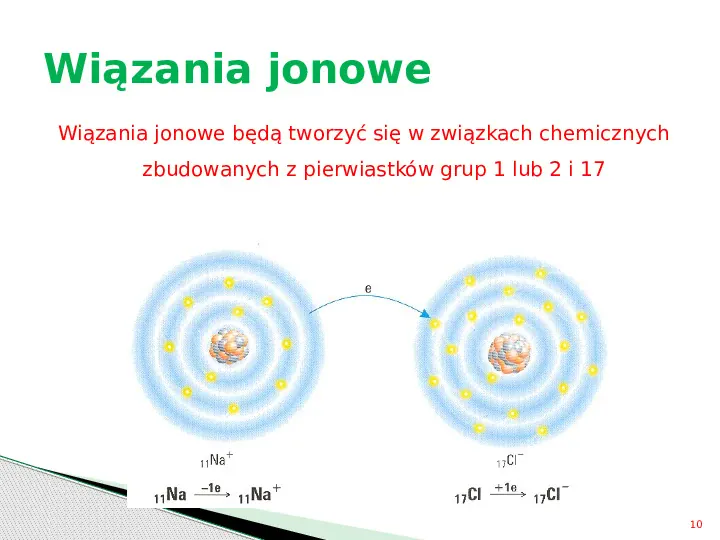
Wiązania jonowe Wiązania jonowe będą tworzyć się w związkach chemicznych zbudowanych z pierwiastków grup 1 lub 2 i 17 10
Slide 11
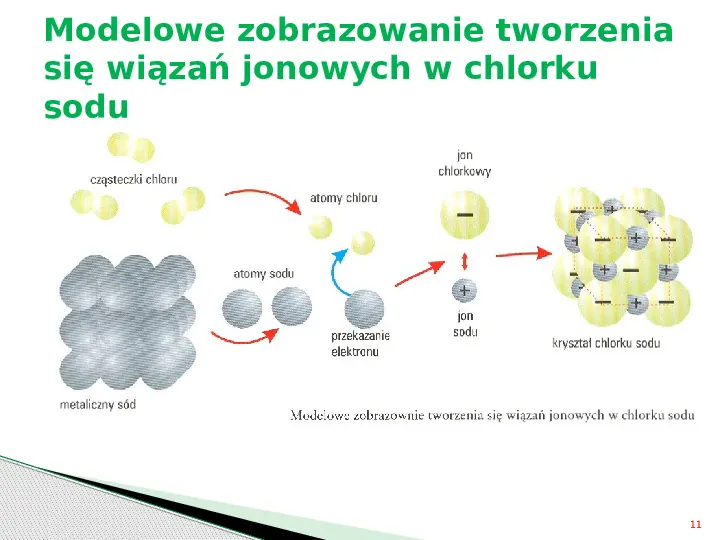
Modelowe zobrazowanie tworzenia się wiązań jonowych w chlorku sodu 11
Slide 12
Wiązanie jonowe Istotą wiązania jonowego jest oddziaływanie elektrostatyczne między jonami powstającymi na skutek przeniesienia elektronów z atomów mniej elektroujemnych do atomów bardziej elektroujemnych w celu uzyskania przez te atomy konfiguracji gazu szlachetnego. 12
Slide 13
Wiązania kowalencyjne (atomowe) cząsteczki homoatomowe np. H2 13
Slide 14
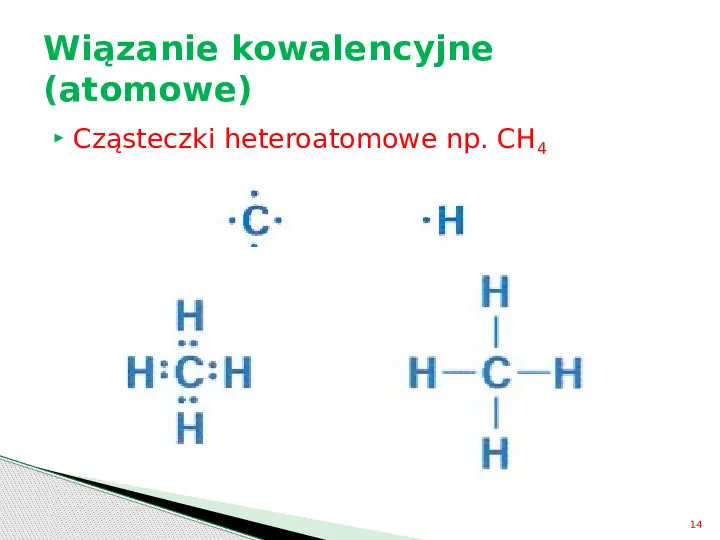
Wiązanie kowalencyjne (atomowe) Cząsteczki heteroatomowe np. CH4 14
Slide 15
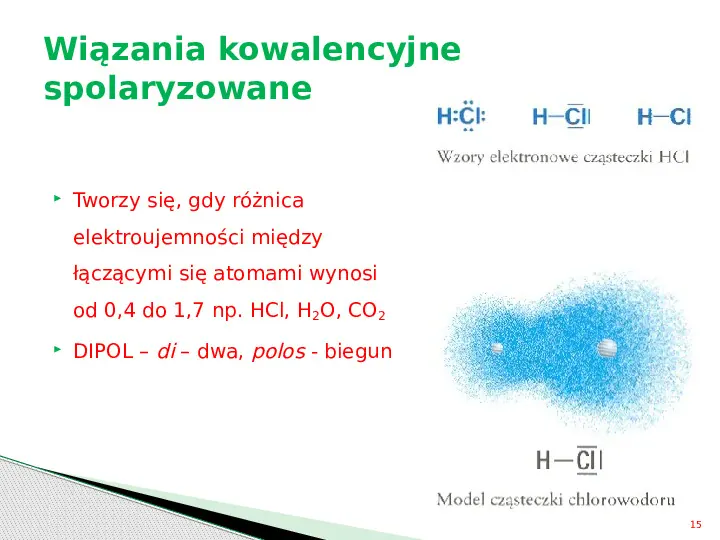
Wiązania kowalencyjne spolaryzowane Tworzy się, gdy różnica elektroujemności między łączącymi się atomami wynosi od 0,4 do 1,7 np. HCl, H2O, CO2 DIPOL di dwa, polos - biegun 15
Slide 16
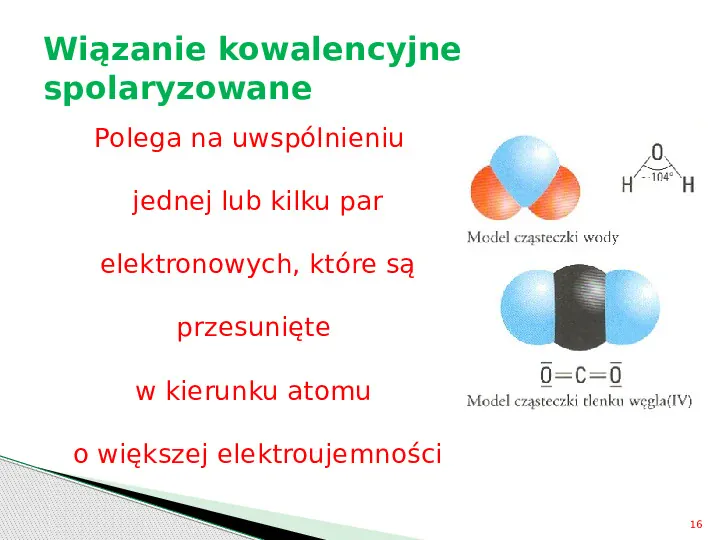
Wiązanie kowalencyjne spolaryzowane Polega na uwspólnieniu jednej lub kilku par elektronowych, które są przesunięte w kierunku atomu o większej elektroujemności 16
Slide 17
Wiązanie wodorowe Powstaje między atomem wodoru, na którym znajduje się ładunek dodatni a wolną parą elektronową atomu pierwiastka o dużej elektroujemności, np. tlenu, fluoru, azotu. 17
Slide 18
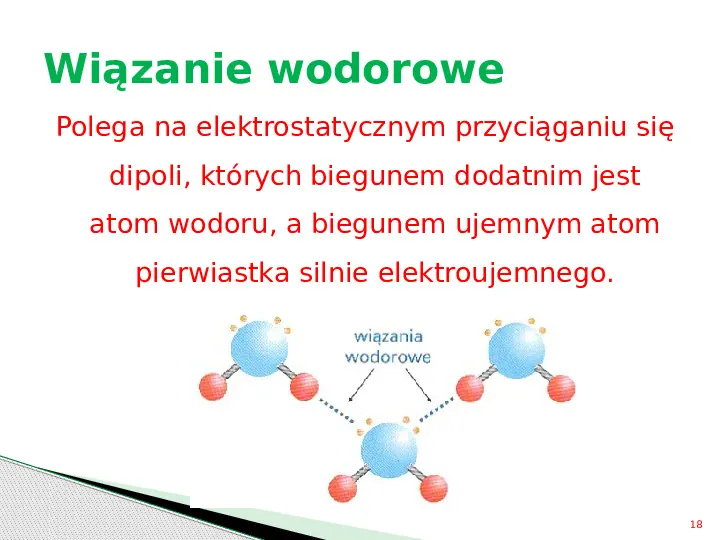
Wiązanie wodorowe Polega na elektrostatycznym przyciąganiu się dipoli, których biegunem dodatnim jest atom wodoru, a biegunem ujemnym atom pierwiastka silnie elektroujemnego. 18
Slide 19
Wiązanie wodorowe Konsekwencją tworzenia wiązań wodorowych jest łączenie się cząsteczek związków w większe zespoły ASOCJACJA 19
Slide 20
Typy wiązań a właściwości związków Wiązanie jonowe przykład chlorek sodu To ciała stałe, krystaliczne, złożone z jonów tworzących tzw. sieć przestrzenną Po stopieniu przewodzą prąd Wysokie temperatury topnienia i wrzenia Większość dobrze rozpuszcza się w wodzie 20
Slide 21
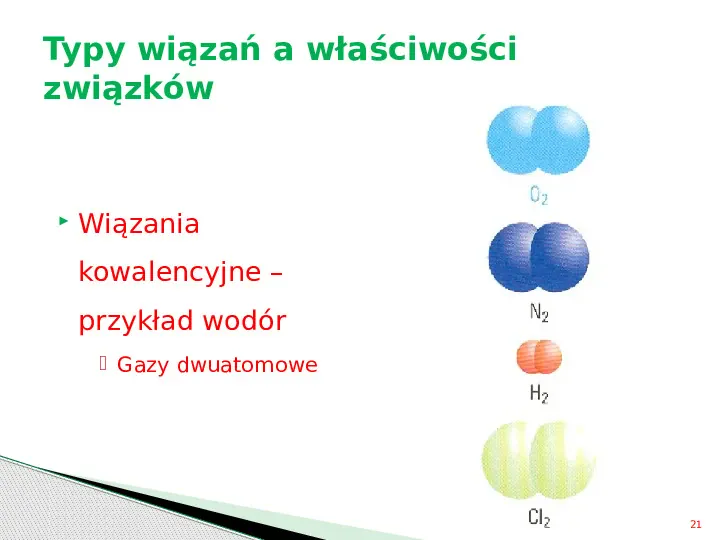
Typy wiązań a właściwości związków Wiązania kowalencyjne przykład wodór Gazy dwuatomowe 21
Slide 22
Typy wiązań a właściwości związków Wiązania kowalencyjne spolaryzowane Właściwości zależą od stopnia polaryzacji http:www.styleandage.plpost4626Woda-to-podstawa 22
Slide 23
Powinieneś: Znać regułę dubletu i oktetu Znać pojęcie elektroujemności Umieć omówić główne typy wiązań chemicznych (jonowe i kowalencyjne) Umieć, na podstawie różnicy elektroujemności określić rodzaj wiązania w związkach typu: A2, AB i A2B 23
Slide 24
Zadania: 24
Slide 25
Zadania c.d.: 25
Dane:
- Liczba slajdów: 25
- Rozmiar: 11.82 MB
- Ilość pobrań: 212
- Ilość wyświetleń: 8642