Zobacz slidy
Treść prezentacji
Slide 1
Alkohole i fenole Opracowanie: Bartłomiej SIEPSIAK klasa 3d Opiekun: p. Teresa Gębicka
Slide 2
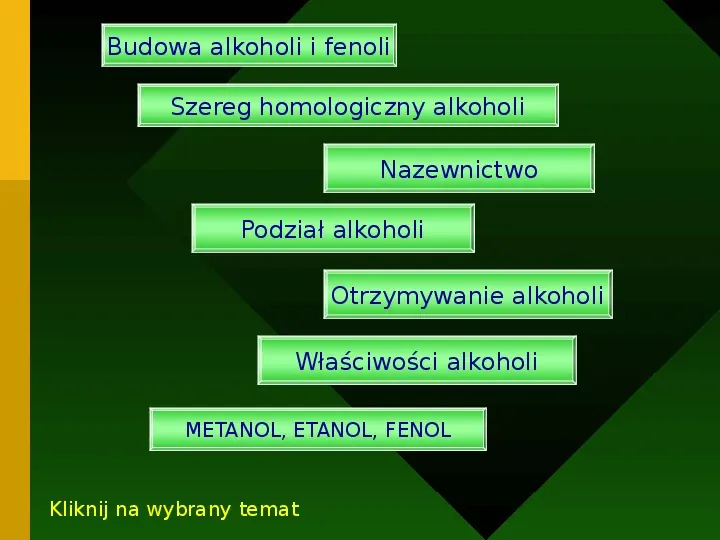
Budowa alkoholi i fenoli Szereg homologiczny alkoholi Nazewnictwo Podział alkoholi Otrzymywanie alkoholi Właściwości alkoholi METANOL, ETANOL, FENOL Kliknij na wybrany temat
Slide 3
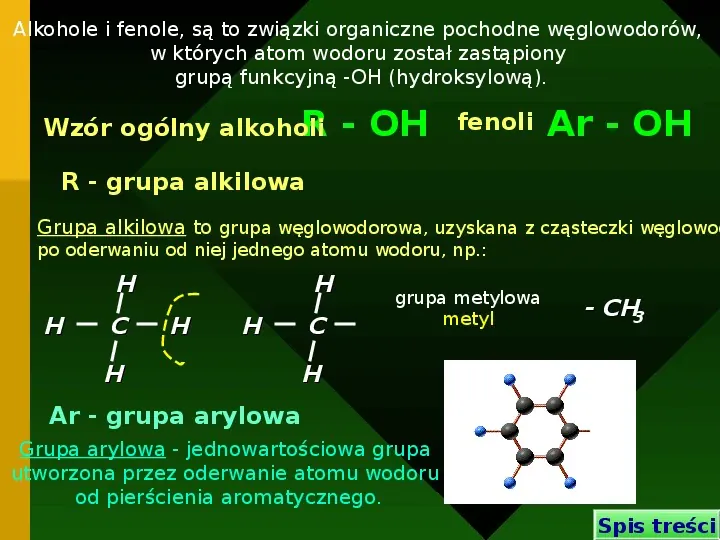
Alkohole i fenole, są to związki organiczne pochodne węglowodorów, w których atom wodoru został zastąpiony grupą funkcyjną -OH (hydroksylową). Wzór ogólny alkoholi R - OH fenoli Ar - OH R - grupa alkilowa Grupa alkilowa to grupa węglowodorowa, uzyskana z cząsteczki węglowod po oderwaniu od niej jednego atomu wodoru, np.: H H C H H H H C grupa metylowa metyl - CH3 H Ar - grupa arylowa Grupa arylowa - jednowartościowa grupa utworzona przez oderwanie atomu wodoru od pierścienia aromatycznego. Spis treści
Slide 4
Alkohole dzielimy ze względu na: rodzaj łańcucha węglowego liczbę grup wodorotlenowych w cząsteczce rzędowość atomu węgla, z którym połączona jest grupa -OH
Slide 5
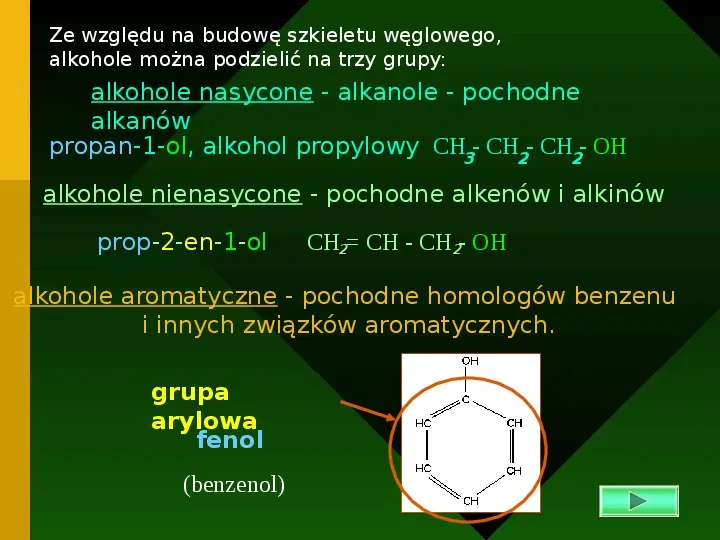
Ze względu na budowę szkieletu węglowego, alkohole można podzielić na trzy grupy: alkohole nasycone - alkanole - pochodne alkanów propan-1-ol, alkohol propylowy CH3- CH2- CH2- OH alkohole nienasycone - pochodne alkenów i alkinów prop-2-en-1-ol CH2 CH - CH2- OH alkohole aromatyczne - pochodne homologów benzenu i innych związków aromatycznych. grupa arylowa fenol (benzenol)
Slide 6
Ze względu na ilość grup wodorotlenowych w cząsteczce, alkohole dzielimy na: jednowodorotlenowe (monohydroksylowe) - alkanole etanol - alkohol etylowyCH3 - CH 2- OH dwuwodorotlenowe (dihydroksylowe) - alkanodiole 1 etano-1,2 -diol glikol etylenowy 2 CH2 - CH 2 OH OH trójwodorotlenowe (trihydroksylowe) - alkanotriole 1 propano-1,2,3-triol gliceryna 2 3 CH2 - CH 2 - CH 2 OH OH OH
Slide 7
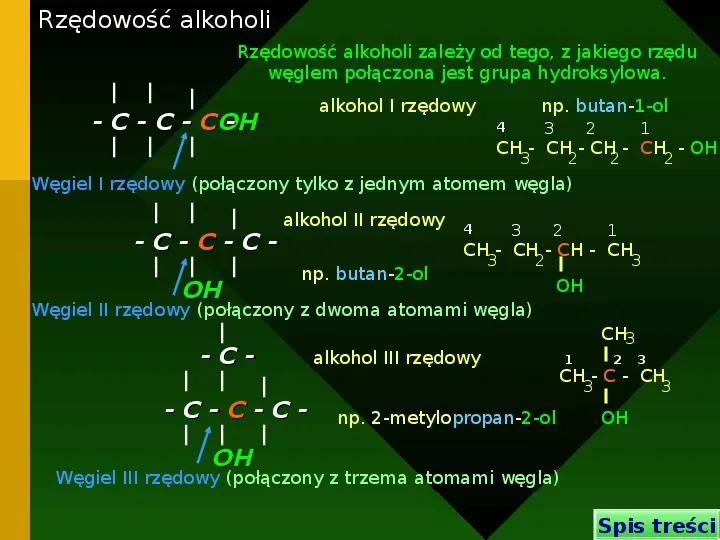
Rzędowość alkoholi Rzędowość alkoholi zależy od tego, z jakiego rzędu węglem połączona jest grupa hydroksylowa. alkohol I rzędowy - C - C - C OH - np. butan-1-ol 4 3 2 1 CH - CH - CH - CH - OH 3 2 2 2 Węgiel I rzędowy (połączony tylko z jednym atomem węgla) -C-C-COH alkohol II rzędowy 4 3 2 1 CH - CH - CH - CH np. butan-2-ol 3 2 3 OH Węgiel II rzędowy (połączony z dwoma atomami węgla) -C-C-C-C- alkohol III rzędowy CH3 1 2 3 CH - C - CH 3 np. 2-metylopropan-2-ol 3 OH OH Węgiel III rzędowy (połączony z trzema atomami węgla) Spis treści
Slide 8
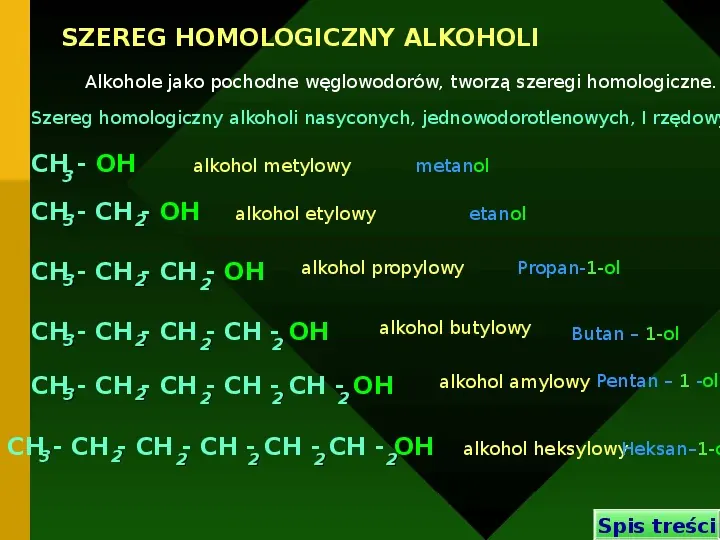
SZEREG HOMOLOGICZNY ALKOHOLI Alkohole jako pochodne węglowodorów, tworzą szeregi homologiczne. Szereg homologiczny alkoholi nasyconych, jednowodorotlenowych, I rzędowy CH3 - OH alkohol metylowy CH3 - CH 2- OH metanol alkohol etylowy CH3 - CH 2- CH 2- OH etanol alkohol propylowy CH3 - CH 2- CH 2- CH -2 OH Propan-1-ol alkohol butylowy CH3 - CH 2- CH 2- CH -2 CH -2 OH CH3 - CH 2- CH 2- CH -2 CH -2 CH -2OH Butan 1-ol alkohol amylowy Pentan 1 -ol alkohol heksylowyHeksan1-o Spis treści
Slide 9
NAZEWNICTWO Nazewnictwo alkoholi jednowodorotlenowych tworzy się od łańcucha węglowodorowego przez dodanie końcówki -ol , poprzedzonej numerem atomu węgla, przy którym znajduje się grupa hydroksylowa. 4 3 2 1 CH - CH - CH - CH - OH CH - OH 3 3 2 2 2 butan-1-ol metanol alkohol metylowy 4 3 2 1 CH - CH - CH - CH 3 2 3 butan-2-ol OH alkohol butylowy Nazwy alkoholi tworzy się również przez dodanie do nazwy odpowiedniej grupy alkilowej, słowastosuje alkohol:się końcówkę W nazwie alkoholi dwuwodorotlenowych -diol 1 2 3 4 butano-2,3-diol CH - CH - CH - CH 3 3 OH OH W nazwie alkoholi trójwodorotlenowych stosuje się końcówkę -triol 1 2 3 4 CH - CH - CH - CH 2 OH 3 OH OH butano - 1,2,3-triol
Slide 10
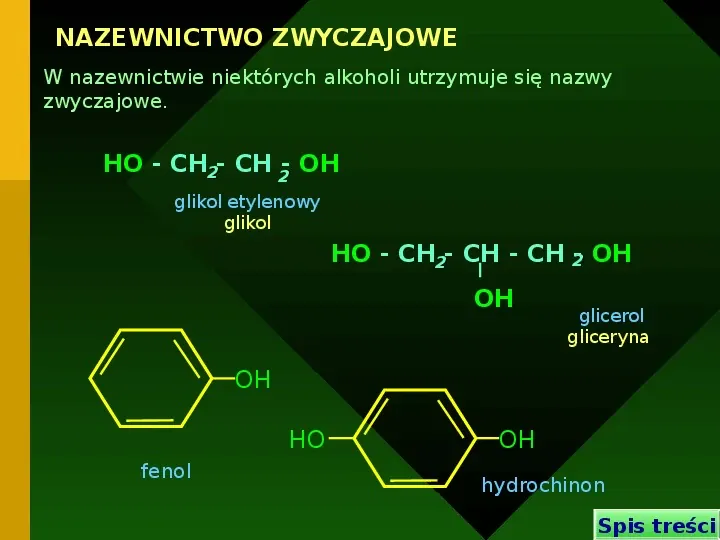
NAZEWNICTWO ZWYCZAJOWE W nazewnictwie niektórych alkoholi utrzymuje się nazwy zwyczajowe. HO - CH2- CH 2- OH glikol etylenowy glikol HO - CH2- CH - CH 2- OH OH glicerol gliceryna OH HO fenol OH hydrochinon Spis treści
Slide 11
Właściwości alkoholi Alkohole należące do szeregu homologicznego zmieniają swoje właściwości fizyczne wraz ze wzrostem wielkości cząsteczki. Alkohole zawierające w cząsteczce do 12 atomów węgla, w temperaturze pokojowej są cieczami, a z większą ilością węgla w cząsteczce są ciałami stałymi. Niższe alkohole mają charakterystyczny alkoholowy zapach i ostry, palący smak. Alkohole o większych cząsteczkach (4-6 atomów węgla w cząsteczce) charakteryzują się słodkawym, duszącym zapachem, który zanika ze wzrostem liczby atomów węgla w cząsteczce. Wraz ze wzrostem wielkości cząsteczki wzrasta temperatura wrzenia alkoholi. Rozpuszczalność i lotność alkoholi maleje szybko wraz ze wzrostem masy cząsteczkowej.
Slide 12
Właściwości chemiczne alkoholi Spalanie alkoholu - reakcja przebiega z udziałem tlenu i w zależności od jego ilości alkohole ulegają: całkowitemu spalaniu, np.: C2 H5 OH 3O2 2CO2 3H2 O półspalaniu, np.: C2 H5 OH 2O2 2CO 3H2 O niecałkowitemu spalaniu, np.: C2 H5 OH O2 2C 3H 2O
Slide 13
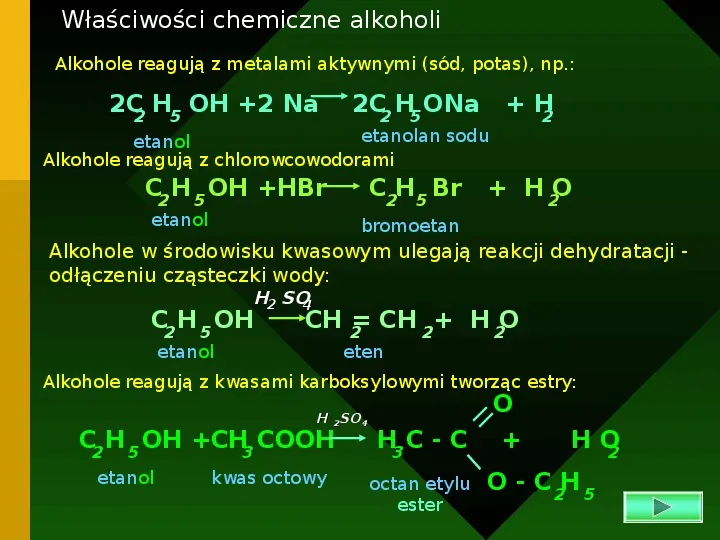
Właściwości chemiczne alkoholi Alkohole reagują z metalami aktywnymi (sód, potas), np.: 2C2 H5 OH 2 Na 2C2 H5 ONa H 2 C2H5 Br H 2O etanolan sodu etanol Alkohole reagują z chlorowcowodorami C2 H 5 OH HBr etanol bromoetan Alkohole w środowisku kwasowym ulegają reakcji dehydratacji odłączeniu cząsteczki wody: H2 SO4 C2 H 5 OH etanol CH 2 CH 2 H 2O eten Alkohole reagują z kwasami karboksylowymi tworząc estry: H 2SO4 C2 H 5 OH CH3 COOH etanol kwas octowy H3 C - C octan etylu ester O HO 2 O - C 2H 5
Slide 14
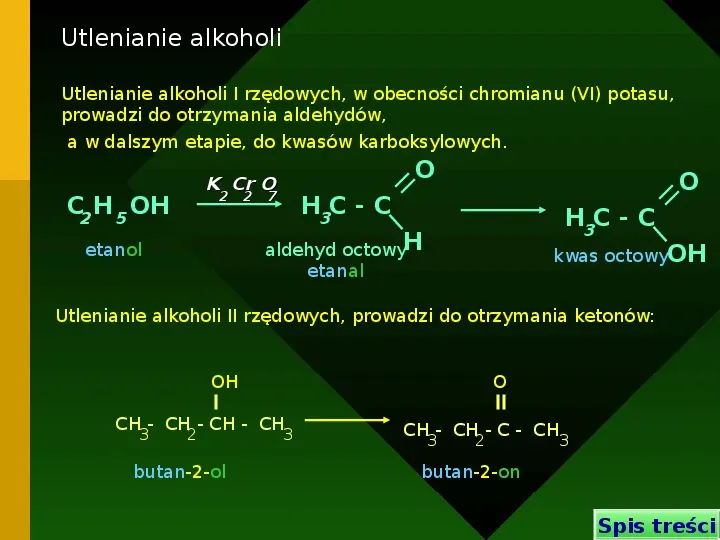
Utlenianie alkoholi Utlenianie alkoholi I rzędowych, w obecności chromianu (VI) potasu, prowadzi do otrzymania aldehydów, a w dalszym etapie, do kwasów karboksylowych. O K Cr O 2 2 7 C2 H 5 OH O H3C - C H3C - C aldehyd octowyH etanal etanol kwas octowyOH Utlenianie alkoholi II rzędowych, prowadzi do otrzymania ketonów: OH O CH - CH - CH - CH 3 2 butan-2-ol 3 CH - CH - C - CH 3 2 3 butan-2-on Spis treści
Slide 15
Otrzymywanie alkoholi Alkohole można otrzymać w reakcji wymiany chlorowcopochodnych węglowodorów z wodorotlenkami np.: C2 H5 Cl AgOH chlorek etylu C2H5OH wodorotlenek srebra etanol AgCL chlorek srebra Alkohol metylowy powstaje z gazu wodnego (gaz do syntez), w odpowiednich warunkach ciśnienia, temperatury i w obecności katalizatora CO 2 2H CH OH 3 metanol Alkohol etylowy powstaje podczas fermentacji alkoholowej cukrów C 6 H 12O 6 glukoza 2C H2 OH 2CO 2 5 etanol Spis treści
Slide 16
METANOL CH3 - OH alkohol metylowy Dawniej nazywany karbinolem, spirytusem drzewnym (jest produktem suchej destylacji drewna). Jest najprostszym alkoholem alifatycznym. Jest bezbarwną cieczą, o charakterystycznym zapachu. Wrze w temperaturze 64,7 oC, krzepnie w temperaturze -97,5 oC. Bardzo dobrze rozpuszcza się w wodzie. Łatwopalny, zwłaszcza jego opary - pali się niebieskim płomienie JEST SILNĄ TRUCIZNĄ! Powoduje utratę wzroku, a większa dawka śmierć! Opary metanolu działają drażniąco na błony śluzowe. Metanol jest ważnym surowcem w przemyśle chemicznym. Stosuje się go jako rozpuszczalnik, paliwo silnikowe, w syntezie organicznej.
Slide 17
ETANOL CH3 - CH 2- OH alkohol etylowy Jest bezbarwną cieczą o charakterystycznym zapachu i piekącym smaku. Wrze w temperaturze 78,3C, krzepnie w temperaturze -117,3C. Jest lżejszy od wody i miesza się z nią w dowolnym stosunku. Pali się niebieskawym płowieniem. Łatwo się utlenia do aldehydu octowego. Z metalami tworzy alkoholany, z kwasami daje estry. Dawniej jedynym źródłem alkoholu etylowego, był proces alkoholowej fermen skrobi zawartej w ziemniakach, kukurydzy lub cukru zawartego w melasie. Poddając destylacji produkty fermentacji otrzymuje się mieszaninę - rektyfik zawierający ok.95 alkoholu etylowego i 5 wody. Etanol ma podobny zapach i smak do metanolu, co bywa przyczyną tragicznych pomyłe Alkohol etylowy jest trucizną, o mniejszej toksyczności niż metanol. Działa depresyjnie, narkotycznie oraz hepatotoksycznie niszczy komórki wątrobowe Narusza strukturę i czynność neuronów, łatwo przenika do komórek nerwowych ośrodkowego układu nerwowego, powodując ich niedotlenienie, prowadzące do zaburzeń czynnościowych. Etanol jest stosowany jako rozpuszczalnik, surowiec w wielu syntezach chemicznych, w przemyśle farmaceutycznym do wyrobu np. nalewek, wyciągów, w przemyśle kosmetycznym do wyrobu perfum, wód toaletowych, w przemyśle spożywczym, w medycynie jako środek odkażający, jako dodatek do paliw silnikowych, paliwo w kuchenkach spirytusowych,.
Slide 18
FENOL OH W temperaturze pokojowej fenol jest substancją stałą, bezbarwną, o charakterystycznym ostrym zapachu. Roztwór wodny fenolu ma odczyn kwaśny i nazywa się go kwasem karbolowym. Fenol ma właściwości trujące i parzące. Z uwagi na jego działanie bakteriobójcze, stosowany jako środek dezynfekuj Fenol jest jedynym z podstawowych surowców syntezy organicznej. Używa się go do otrzymywania tworzyw sztucznych, zwanych fenoplastami. Fenol stanowi substancję wyjściową do produkcji: leków (np. aspiryny), barwników i materiałów wybuchowych. Spis treści
Dane:
- Liczba slajdów: 18
- Rozmiar: 1.40 MB
- Ilość pobrań: 381
- Ilość wyświetleń: 12345