Zobacz slidy
Treść prezentacji
Slide 1
Wydzielanie wodoru: mechanizm reakcji wydzielania wodoru (reakcja Volmera, reakcja Tafela, reakcja Heyrovskiego) Wpływ entalpii swobodnej adsorpcji wodoru na elektrodzie na nadpotencjał wydzielania wodoru
Slide 2
Wydzielanie wodoru było jednym z pierwszych procesów elektrochemicznych, który został dokładnie zbadany. Proces ten przebiega na różnych metalach według różnych mechanizmów z większym lub mniejszym nadnapięciem. Nadnapięcie tutaj definiuje się jako różnicę pomiędzy potencjałem elektrody, na której wydziela się wodór przy danej gęstości prądu, a potencjałem równowagowym elektrody wodorowej w tym samym roztworze.
Slide 3
Od tego czasu poprowadzono bardzo wiele badań zmierzających do wyjaśnienia mechanizmu reakcji elektrodowej. Z badań tych rozwinęły się podstawowe pojęcia kinetyki procesów elektrodowych. Pomimo tego również w nowszych czasach nie udało się całkowicie wyjaśnić tego bardzo skomplikowanego mechanizmu, który w znacznym stopniu zależy od warunków doświadczenia i może ulegać znacznym zmianom zależnie od zastosowanego metalu elektrody.
Slide 4
Zgodnie z obecnym ujęciem otrzymujemy reakcję sumaryczną: 2H3O 2e H2 2H2O którą można rozłożyć na następujące procesy cząstkowe: 1. Transport jonów H3O do granicy faz. 2. Rozładowanie jonów H3O a)na powierzchni pracującej elektrody na miejscach nie zajętych przez atomy wodoru z utworzeniem zaadsorbowanych atomów wodoru (reakcja Volmera) H3O Me e MeH H2O
Slide 5
b) na powierzchni pracującej elektrody na miejscach zajętych przez atomy wodoru z utworzeniem cząsteczek H 2 (reakcja Heyrovskiego) H3O MeH e Me H2 H2O 3. Rekombinacja dwóch zaadsorbowanych atomów wodoru z utworzeniem H2 (reakcja Tafela) MeH MeH 2Me H2 4. Desorpcja H2 z powierzchni do roztworu. 5. Odtransportowanie cząsteczek H 2 a) drogą dyfuzji, b) przez wydzielanie pęcherzyków gazu.
Slide 6
Najwolniejszy z procesów cząstkowych reakcji wydzielania wodoru określa przebieg stacjonarnej krzywej prąd-napięcie. Jaki to jest proces, zależy w konkretnym przypadku od użytego metalu, a nawet od rodzaju stałej powierzchni metalu, która jest zwykle w znacznym stopniu niejednorodna, w związku z czym energia aktywacji poszczególnych reakcji cząstkowych może być różna w różnych miejscach (centra aktywne).
Slide 7
Parsons i Gerischer wykazali, że szybkość reakcji Heyrovskiego zależy od entalpii swobodnej adsorpcji atomu wodoru, która i w tym przypadku jest funkcją materiału elektrody i jej struktury. Względne szybkości podanych reakcji decydują o tym, jaki będzie mechanizm sumarycznego procesu wydzielania lub jonizacji wodoru i która z reakcji będzie określać szybkość tego procesu.
Slide 8
Im silniej jest zaadsorbowany wodór na materiale elektrody, tym szybciej przebiega właściwa elektroredukcja jonów wodorowych przy danym potencjale. Nadnapięcie jest więc największe na takich elektrodach, na których wodór ulega adsorpcji tylko w bardzo nieznacznym stopniu, np. na Hg, Pb, Tl, Cd, Zn, Ga i Ag. Na tych elektrodach proces elektrodowy jest określony przez reakcję Volmera. Bardzo szybkim procesem jest niewątpliwie jedna z reakcji następczych prowadzących do powstania cząsteczek wodoru.
Slide 9
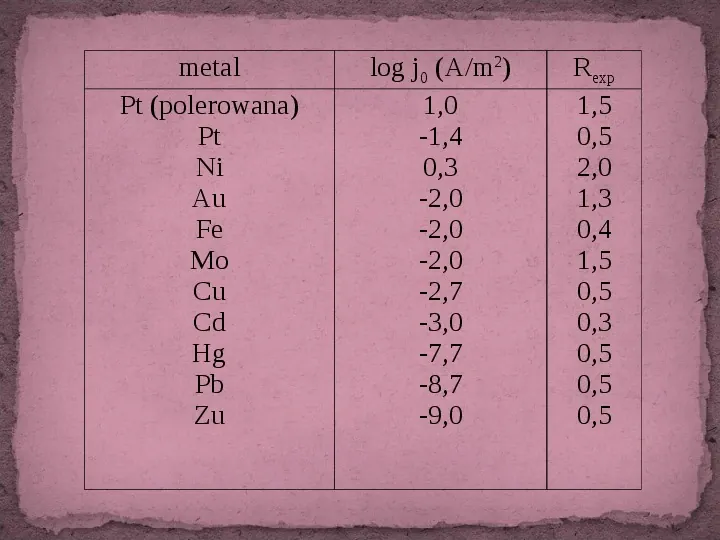
Zależnie od rodzaju metalu zmienia się trwałość wiązań M-H, co uwidacznia wartość swobodnej entalpii adsorpcji atomów wodoru. Oznacza to, że natura metalu ma ogromny wpływ na kinetykę i mechanizm procesu wydzielania katodowego wodoru. Eksperymentalnie wyraża się to w wartościach prądu wymiany i współczynniku przejścia elektronu:
Slide 10
metal Pt (polerowana) Pt Ni Au Fe Mo Cu Cd Hg Pb Zu log j0 (Am2) 1,0 -1,4 0,3 -2,0 -2,0 -2,0 -2,7 -3,0 -7,7 -8,7 -9,0 Rexp 1,5 0,5 2,0 1,3 0,4 1,5 0,5 0,3 0,5 0,5 0,5
Slide 11
Związek między szybkością wydzielania wodoru na danej elektrodzie(miarą jest gęstość prądu wymiany jo) a entalpią swobodną adsorpcji wodoru ilustruje krzywa wulkaniczna. log jo Entalpia wiązania M-H[kJmol]
Slide 12
Podsumowanie Reakcja Volmera jest reakcją przeniesienia elektronu od elektrody do hydratyzowanego protonu (jon hydroniowy) i adsorpcja atomowego wodoru na powierzchnie elektrody. Dalej zaabsorbowane wodory mogę ulegać rekombinacji (reakcja Tafela) lub mogą uczestniczyć w reakcji z protonem(jonem hydroniowym) i elektronem (reakcja Heyrovskiego), przy czym w obu przypadkach tworzy się cząsteczka wodoru.
Slide 13
Gustaw Kortüm, Elektrochemia, Warszawa, Państwowe Wydawnictwo Naukowe Jiŕi Koryta, Vlasta Bohăčkovă, Elektrochemia, Warszawa, Państwowe Wydawnictwo Naukowe Henryk Scholl, Tadeusz Błaszczyk, Paweł Krzyczmonik, Elektrochemia, Łódź, Wydawnictwo Uniwersytetu Łódzkiego
Slide 14
Dziękuję za uwagę
Dane:
- Liczba slajdów: 14
- Rozmiar: 1.77 MB
- Ilość pobrań: 59
- Ilość wyświetleń: 5028