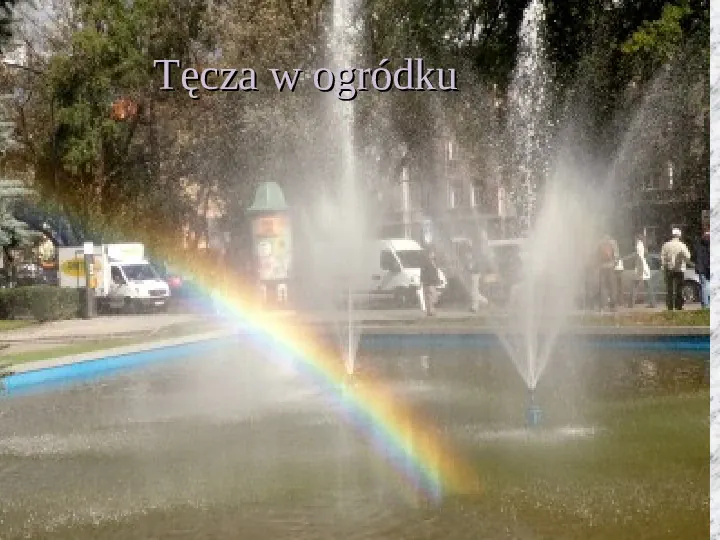Zobacz slidy
Treść prezentacji
Slide 1
Świat pełen barw
Slide 2
Wyobraź sobie jednobarwny świat- biały albo szary Monotonny świat co nie?
Slide 3
Kolory w naszym życiu Aby dostrzec barwy czyli kolory potrzebne jest światło. Źródłem światła może być żarówka, świeca, ale najbardziej powszechnym jest
Slide 4
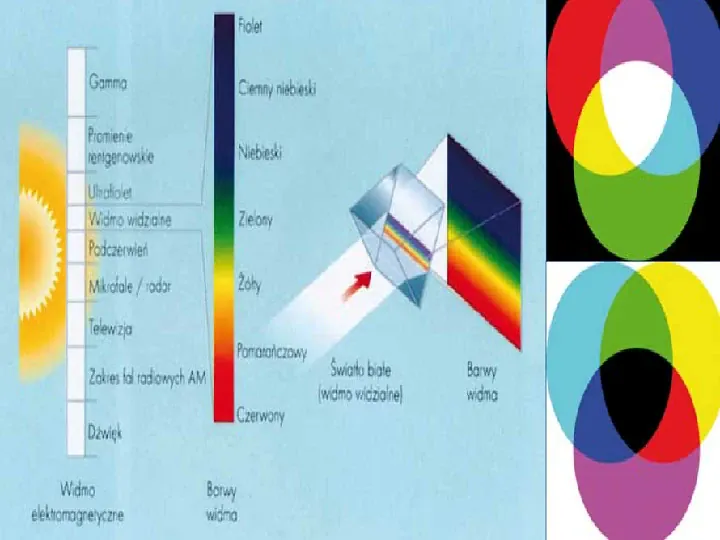
Z jakich barw składa się światło słoneczne? Światło słoneczne , które widzimy jest białe. Ale tak naprawdę, składa się z wielu barw: czerwonej , pomarańczowej, żółtej, zielonej, niebieskiej, granatowej i fioletowej
Slide 5
Barwy te po wymieszaniu i nałożeniu jedna na druga dają barwę białą. Doświadczenie1. Jeżeli tak wykonaną tarczę z tektury nabijemy w środku na ołówek i zaczniemy szybko obracać to wskutek szybkiego ruchu różnobarwna tarcza wydaje się niemal biała. Różne barwy mieszają się ze sobą, dając jedną barwę- prawie białą
Slide 6
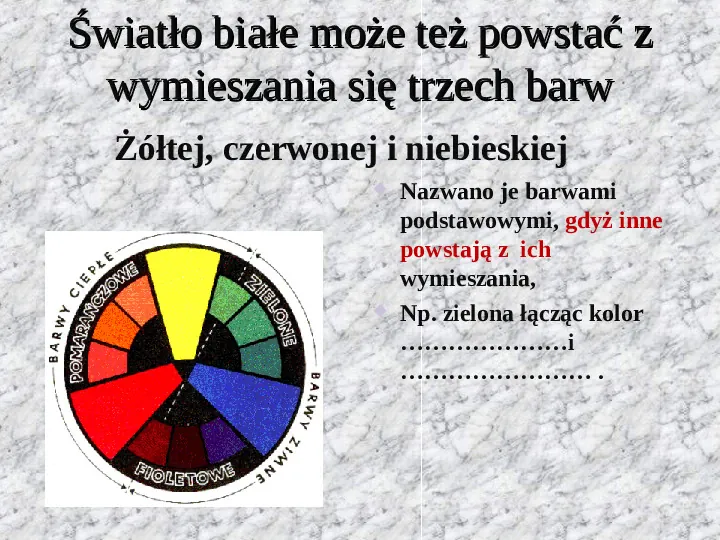
Światło białe może też powstać z wymieszania się trzech barw Żółtej, czerwonej i niebieskiej Nazwano je barwami podstawowymi, gdyż inne powstają z ich wymieszania, Np. zielona łącząc kolor i .
Slide 7
Kolejny dowód powstawania barwy białej z wielu barw to tęcza Powstaje ona , gdy jedna część nieba jest już słoneczna, a w drugiej pada jeszcze deszcz. Jeśli krople wody zostaną oswietlone przez promienie słońca , a my stoimy tyłem do słonca to wówczas swiatło białe się w każdej z nich załamuje i rozszczepia , dajac wielobarwny łukod czerwieni do fioletu
Slide 8
Tęcza w ogródku
Slide 10
Jaki kolor widzimy? Widzimy nie tylko przedmioty i obiekty będące źródłami swiatła , ale widzimy także te , które odbijają promienie świetlne. Kolor przedmiotu zależy od tego , jakie barwy on pochłania, a jakie odbija.
Slide 11
Jeżeli do oczu dociera barwa biała to znaczy ,że ten przedmiot odbija wszystkie barwy.
Slide 12
Jeżeli przedmiot pochłania wszystkie barwy to widzimy tylko kolor czarny. Np. węgiel widzimy czarny ponieważ pochłania on wszystkie barwy
Slide 13
Liście roślin widzimy jako zielone ponieważ pochłania on wszystkie barwy , odbija tylko zielony i ona tylko dociera do naszych oczu.
Slide 14
Słońce wysyła nam nie tylko światło , ale także ciepło. Latem ,a zmniejszamy ilość ciepła jaka dostarcza do naszego organizmu, ubieramy wtedy ubrania jasne, których większosć barw odbijają , a nie pochlaniają. Zima zakładamy ciemne ubrania, aby jak najwięcej promieni słonecznych nas ogrzało.
Slide 15
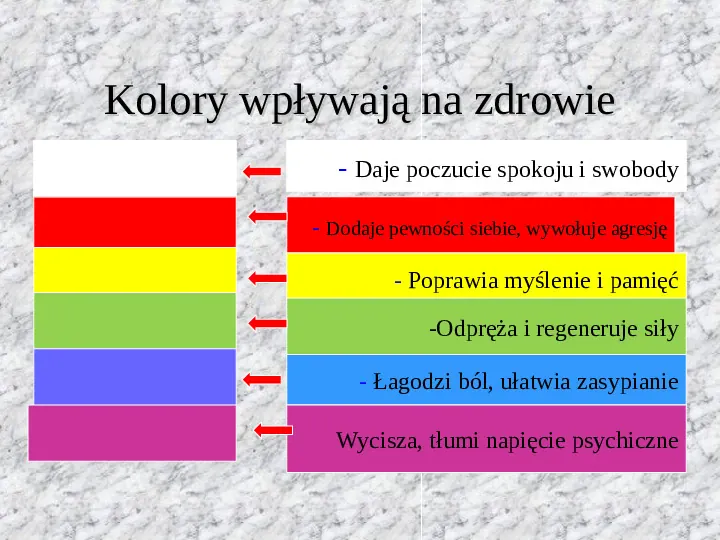
Kolory wpływają na zdrowie - Daje poczucie spokoju i swobody - Dodaje pewności siebie, wywołuje agresję - Poprawia myślenie i pamięć -Odpręża i regeneruje siły - Łagodzi ból, ułatwia zasypianie Wycisza, tłumi napięcie psychiczne
Slide 16
Sprawdź, czy wiesz.. Wymień nazwy barw wchodzące w skład światła białego Podaj warunki, w jakich możliwe jest widzenie tęczy Wyjaśnij, kiedy przedmiot ma kolor czerwony Wyjaśnij , dlaczego zima ubieramy się na ciemno , a latem na jasno.
Dane:
- Liczba slajdów: 16
- Rozmiar: 1.68 MB
- Ilość pobrań: 893
- Ilość wyświetleń: 16705