Zobacz slidy
Treść prezentacji
Slide 1
Podwójna warstwa elektryczna
Slide 2
Podwójna warstwa elektryczna Przy granicy rozdziału dwóch faz powstaje obszar, w którym natężenie pola elektrycznego ma wartość różną od zera. Źródłem tego pola jest nadmiarowy ładunek elektrycznie naładowanych cząsteczek jonów, elektronów i zorientowanych dipoli. Obszar, w którym występuje ładunek nadmiarowy, nosi nazwę podwójnej warstwy elektrochemicznej. 2
Slide 3
Podwójna warstwa elektryczna Powszechnie spotykamy się z warstwą na granicy faz: ciecz ciecz (dla niemieszających się cieczy), ciecz powietrze (zwana swobodną powierzchnią roztworu), elektroda gaz (w znikomym stopniu dotyczy elektrochemii), elektroda roztwór (zasadnicza grupa zagadnień) 3
Slide 4
Poglądy na budowę podwójnej warstwy elektrycznej Istnieje kilka modeli podwójnej warstwy elektrycznej: Model Helmholtza Model Gouya Chapmana Model Sterna 4
Slide 5
Model Helmholtza Herman L. F. von Helmholtz (1821-1894), profesor fizyki Uniwersytetu w Berlinie. Zaproponował model warstwy elektrochemicznej oparty na budowie kondensatora elektrycznego. Rys. Herman L. F. von Helmholtz 5
Slide 6
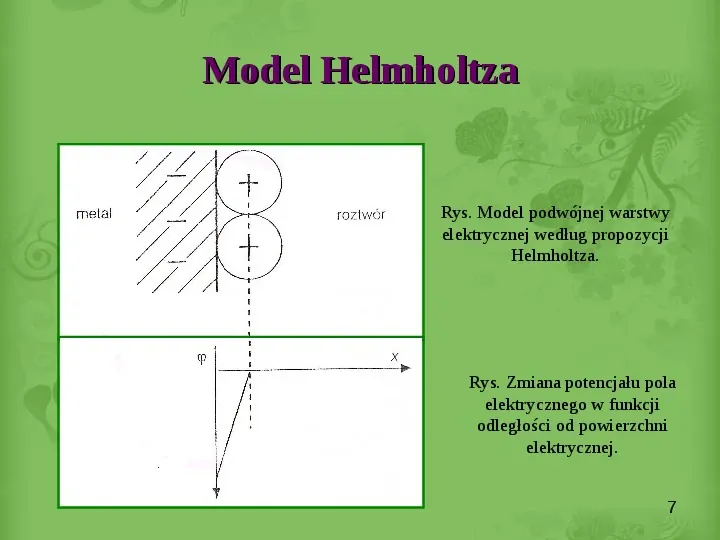
Model Helmholtza Helmholtz sądził, że ładunek elektryczny dodatni lub ujemny znajdujący się na powierzchni metalu jest neutralizowany przez jony tworzące warstewkę ściśle przylegającą do powierzchni metalu. Fizyczna podstawa tego modelu to warstwa jonów zaadsorbowanych na powierzchni. Matematyczny opis polegał na porównaniu tej warstwy do kondensatora, którego jedną z okładek stanowi powierzchnia ciała stałego a drugą otaczający je roztwór. 6
Slide 7
Model Helmholtza Rys. Model podwójnej warstwy elektrycznej według propozycji Helmholtza. Rys. Zmiana potencjału pola elektrycznego w funkcji odległości od powierzchni elektrycznej. 7
Slide 8
Model Gouya - Chapmana Louis - George Gouy (1854-1926) w dyskusji z Helmholtzem rozwinął teorię warstwy podwójnej. Dawid L. Chapman (1869-1958) zajmował się głównie teorią kinetyki reakcji w fazie gazowej, ale wniósł też poważny wkład w teorię warstwy 8 podwójnej.
Slide 9
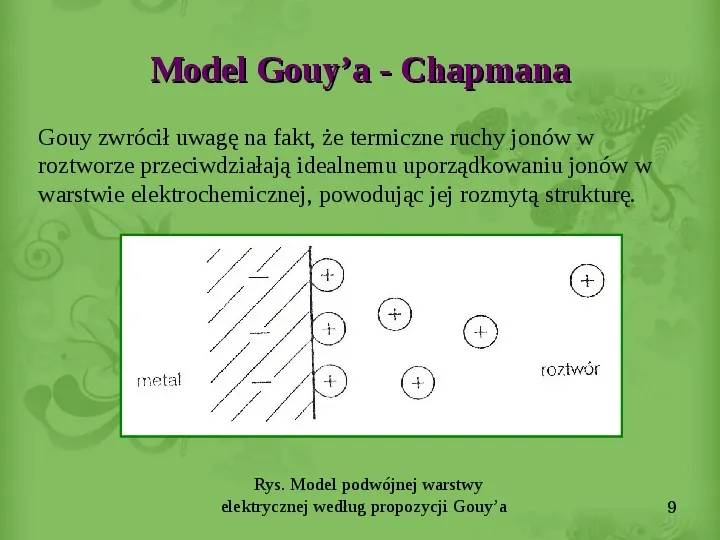
Model Gouya - Chapmana Gouy zwrócił uwagę na fakt, że termiczne ruchy jonów w roztworze przeciwdziałają idealnemu uporządkowaniu jonów w warstwie elektrochemicznej, powodując jej rozmytą strukturę. Rys. Model podwójnej warstwy elektrycznej według propozycji Gouya 9
Slide 10
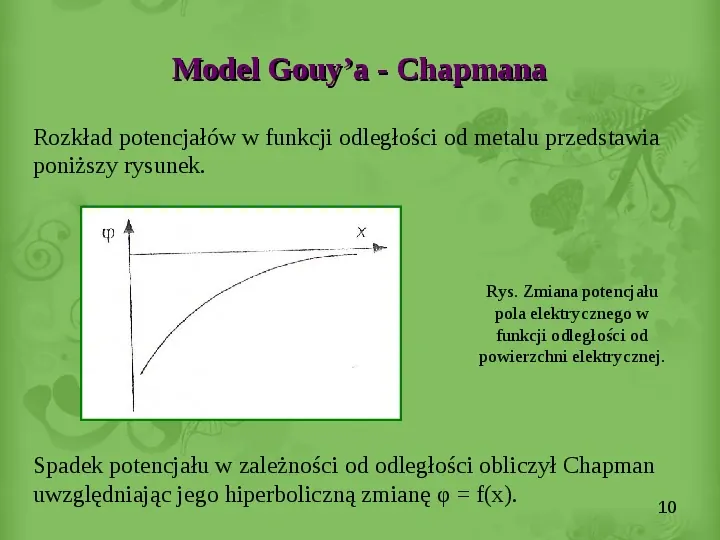
Model Gouya - Chapmana Rozkład potencjałów w funkcji odległości od metalu przedstawia poniższy rysunek. Rys. Zmiana potencjału pola elektrycznego w funkcji odległości od powierzchni elektrycznej. Spadek potencjału w zależności od odległości obliczył Chapman uwzględniając jego hiperboliczną zmianę φ f(x). 10
Slide 11
Model Sterna Otto Stern (1888-1969) zajmował się badaniami zderzeń molekularnych i problemami dyfuzji. Jego propozycja ułatwiła rozwinięcie teorii warstwy podwójnej. Rys. Otto Stern 11
Slide 12
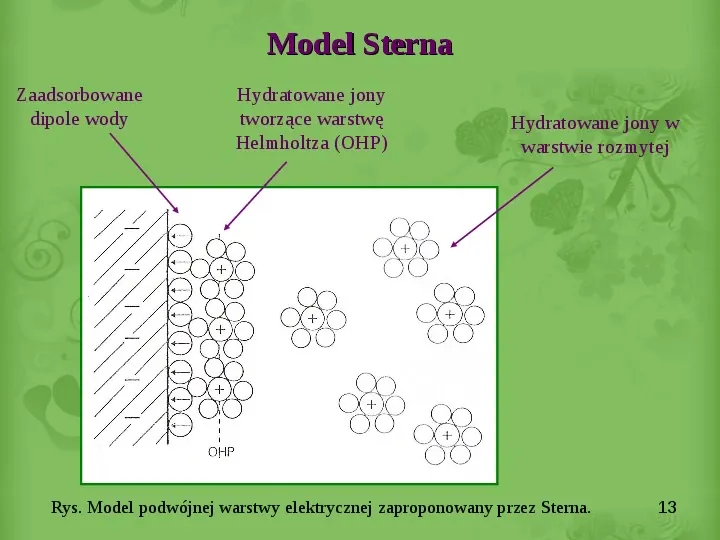
Model Sterna Połączeniem pomiędzy modelami Helmholtza i Gouya Chapmana była teoria Sterna obowiązująca z modyfikacjami do dnia dzisiejszego. W myśl teorii Sterna warstwa elektrochemiczna składa się z dwóch części: sztywnej i rozmytej. Warstwę sztywną tworzą jony bezpośrednio sąsiadujące z powierzchnią metalu, warstwę rozmytą (dyfuzyjną) tworzą jony bardziej odległe od metalu, wykonujące translacyjne, chaotyczne ruchy cieplne, lecz będące równocześnie w stanie swoistego uporządkowania oddziaływaniami elektrostatycznymi z ładunkiem elektrycznym znajdującym się na powierzchni metalu. 12
Slide 13
Model Sterna Zaadsorbowane dipole wody Hydratowane jony tworzące warstwę Helmholtza (OHP) Hydratowane jony w warstwie rozmytej Rys. Model podwójnej warstwy elektrycznej zaproponowany przez Sterna. 13
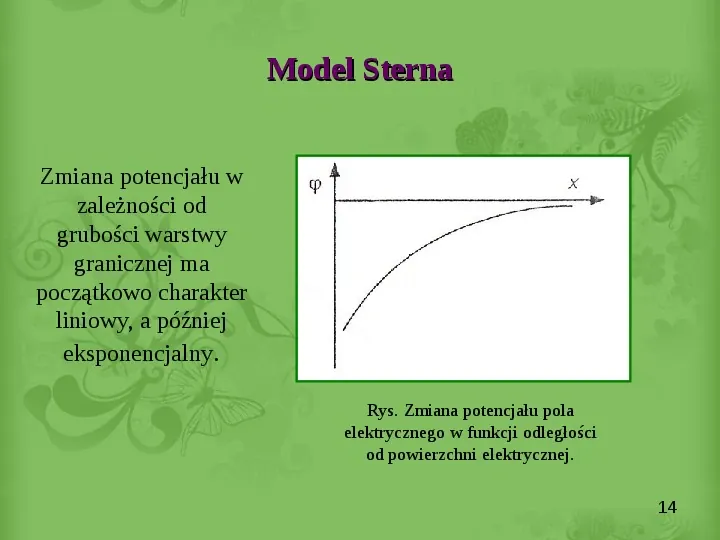
Slide 14
Model Sterna Zmiana potencjału w zależności od grubości warstwy granicznej ma początkowo charakter liniowy, a później eksponencjalny. Rys. Zmiana potencjału pola elektrycznego w funkcji odległości od powierzchni elektrycznej. 14
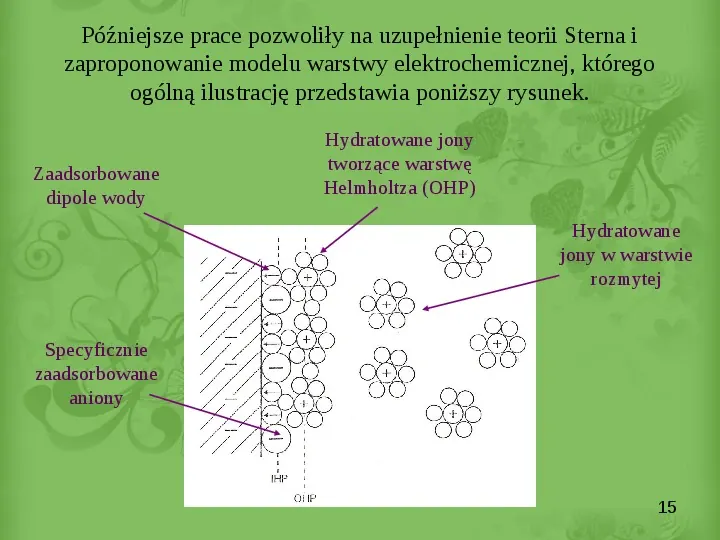
Slide 15
Późniejsze prace pozwoliły na uzupełnienie teorii Sterna i zaproponowanie modelu warstwy elektrochemicznej, którego ogólną ilustrację przedstawia poniższy rysunek. Zaadsorbowane dipole wody Hydratowane jony tworzące warstwę Helmholtza (OHP) Hydratowane jony w warstwie rozmytej Specyficznie zaadsorbowane aniony 15
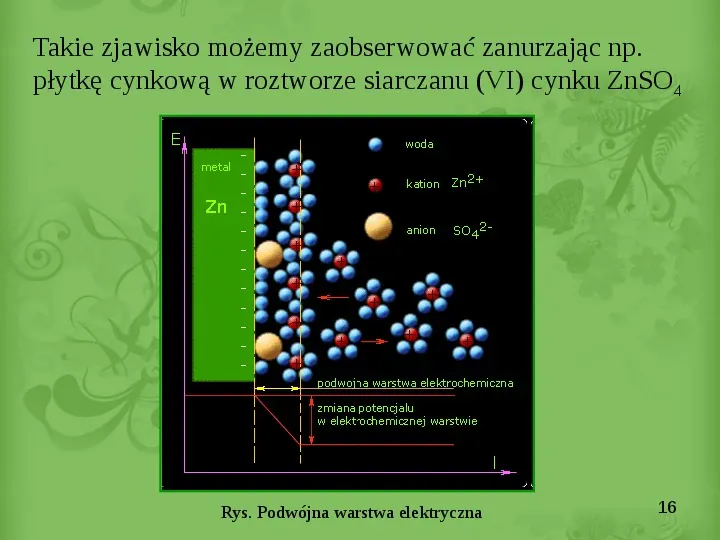
Slide 16
Takie zjawisko możemy zaobserwować zanurzając np. płytkę cynkową w roztworze siarczanu (VI) cynku ZnSO4 Rys. Podwójna warstwa elektryczna 16
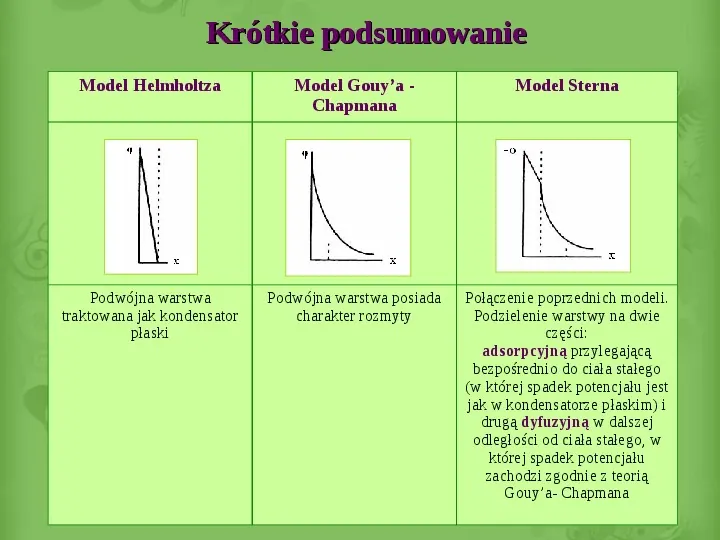
Slide 17
Krótkie podsumowanie Model Helmholtza Model Gouya Chapmana Model Sterna Podwójna warstwa traktowana jak kondensator płaski Podwójna warstwa posiada charakter rozmyty Połączenie poprzednich modeli. Podzielenie warstwy na dwie części: adsorpcyjną przylegającą bezpośrednio do ciała stałego (w której spadek potencjału jest jak w kondensatorze płaskim) i drugą dyfuzyjną w dalszej odległości od ciała stałego, w której spadek potencjału zachodzi zgodnie z teorią Gouya- Chapmana 17
Slide 18
Rola podwójnej warstwy elektrycznej Powstawanie podwójnej warstwy elektrycznej odgrywa istotną rolę: w wielu procesach, np. adsorpcyjnych, elektrochemicznych, przekazywania impulsów elektrycznych przez błony komórkowe, w zjawiskach elektrokapilarnych, określa trwałość koloidów, wpływa na wiele właściwości granicy faz (np. współczynniki tarcia, zwilżalność). 18
Slide 19
Bibliografia: H. Scholl, T. Błaszczyk, P. Krzyczmonik, Elektrochemia. Zarys teorii i praktyki, Łódź 1998 J. Kuryłowicz, Elektrochemia, Warszawa 1980 http:www.chemia.dami.pl http:pl.wikipedia.org 19
Dane:
- Liczba slajdów: 19
- Rozmiar: 1.51 MB
- Ilość pobrań: 116
- Ilość wyświetleń: 6480