Zobacz slidy
Treść prezentacji
Slide 1
LANTANOWCE 1
Slide 2
PLAN PREZENTACJI 1. 2. 3. 4. 5. 6. 7. 8. Lantanowce Występowanie lantanowców w przyrodzie Rozdzielanie i otrzymywanie lantanowców Metody rozdzielania lantanowców Widma elektronowe lantanowców, właściwości optyczne Przejścia f f Luminescencja lantanowców Właściwości magnetyczne 2
Slide 3
LANTANOWCE Nazwa lantanowce obejmuje 14 pierwiastków położonych w układzie okresowym za lantanem. Lantanowce zwane czasami metalami ziem rzadkich i występują w przyrodzie razem; są one metalami o charakterze elektrododatnim. W ich chemii dominuje stopień utlenienia 3 i jony o konfiguracji (4f)n . Pod względem właściwości chemicznych wszystkie lantanowce są do siebie podobne. 3
Slide 4
4
Slide 5
WYSTĘPOWANIE LANTANOWCÓW W PRZYRODZIE Lantanowce zarówno jak skandowce występują w przyrodzie głównie w postaci fosforanów i krzemianów. Zbliżony promień jonowy i duże podobieństwo chemiczne tych pierwiastków powoduje, że spotykamy je niemal wszystkie obok siebie w tych samych minerałach. 5
Slide 6
Do najważniejszych minerałów zawierających lantanowce należy monacyt, CePO4 występujący w złożach pierwotnych w pegmatytach, granitach i gnejsach, a także często w postaci lepiej nadającego się do eksploatacji piasku monacytowego. 6 6
Slide 7
Innym minerałem zawierającym lantanowce jest bastnazyt o wzorze sumarycznym LnFCO3 , który występuje w Kalifornii. 7 7
Slide 8
Cięższe lantanowce o liczbach atomowych od 64 do 71 (od gadolinu do lutetu) występują natomiast w minerałach zawierających itr. Do najważniejszych minerałów tego rodzaju należy gadolinit, o wzorze sumarycznym Y2FeIIBe2Si2O10 8 8
Slide 9
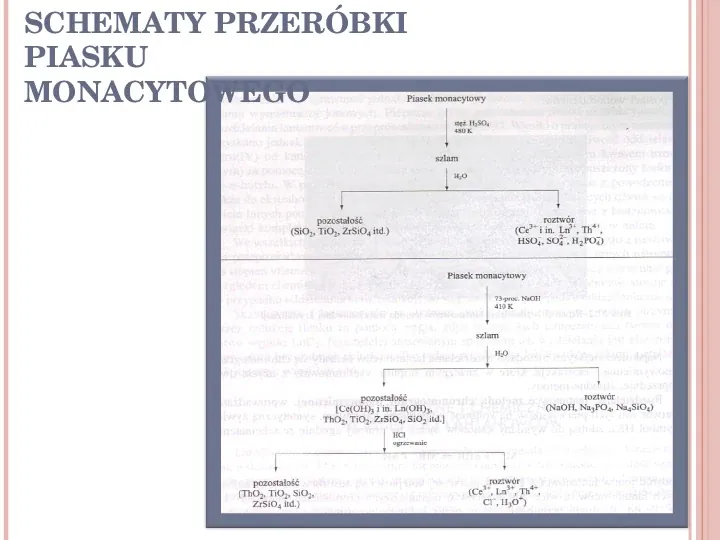
ROZDZIELANIE I OTRZYMYWANIE LANTANOWCÓW Przeróbka rud lantanowców uzależniona jest od chemicznego składu rudy i może mieć różny przebieg. W poniższych tabelach przedstawione są dwa schematy wstępnej przeróbki piasku monacytowego, mającego na celu oddzielenie zanieczyszczeń: krzemionki, związków tytanu i cyrkonu. 9
Slide 10
SCHEMATY PRZERÓBKI PIASKU MONACYTOWEGO 10
Slide 11
METODY ROZDZIELANIA LANTANOWCÓW Rozdzielanie lantanowców stanowi jedno z najtrudniejszych zadań nieorganicznej preparatyki chemicznej. Do najważniejszych metod stosowanych w celu rozdziału tych związków należą: 1. Krystalizacja frakcjonowana 2. Frakcjonowane strącanie z roztworu 3. Chromatografia jonowymienna 11 4. Ekstrakcja
Slide 12
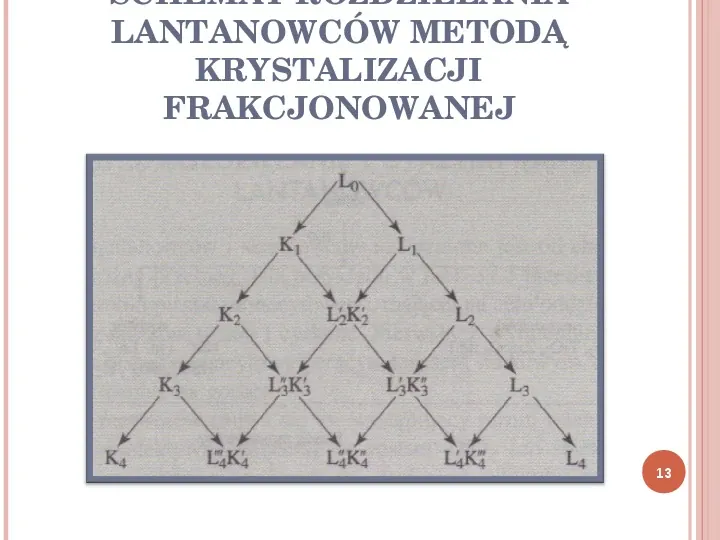
KRYSTALIZACJA FRAKCJONOWANA Rozdzielanie lantanowców metodą frakcjonowanej krystalizacji polega na wykorzystaniu niewielkich różnic w rozpuszczalności niektórych soli lantanowców. Krystalizację przeprowadza się zawsze z roztworów wodnych. 12
Slide 13
SCHEMAT ROZDZIELANIA LANTANOWCÓW METODĄ KRYSTALIZACJI FRAKCJONOWANEJ 13
Slide 14
W krystalizacji frakcjonowanej do rozdzielania lantanowców jako związki dające najefektywniejsze rozdzielania stosuje się: bromiany Ln(BrO3)39H2O i etylosiarczany Ln2(C2H5SO4)39H2O do rozdzielania grupy itrowej i oddzielenia itru siarczany Ln(SO4)38H2O do oddzielenia lantanu, ceru, a przede wszystkim rozdzielania lantanowców zawierających grupę cerową i itrową azotany Ln(SO4)35H2O do oddzielenia gadolinu podwójne azotany Ln(NO3)32NH4NO34H2O do wydzielania lantanu i rozdzielenia pary prazeodym neodym podwójne azotany 2Ln(NO3)33Mg(NO3)224H2O do rozdzielania grupy cerowej (lecz nie grupy itrowej) Frakcjonowana krystalizacja jest bardzo efektywna dla lantanu i lekkich lantanowców, których sole znacznie bardziej różnią się 14 rozpuszczalnością.
Slide 15
FRAKCJONOWANE STRĄCANIE Różnica między krystalizacją a procesem strącania dotyczy sposobu powstawania osadu soli i jej rozpuszczalności. W metodzie strącania stosuje się reakcje dwu lub więcej soli, której produkt jest trudniej rozpuszczalny w danym środowisku niż substraty. Można wyróżnić trzy główne rodzaje strącania frakcjonowanego: strącanie różnych soli bez wytworzenia kompleksów strącanie wodorotlenków, czyli tzw. strącanie zasadowe strącanie w obecności czynnika kompleksującego 15
Slide 16
STRĄCANIE RÓŻNYCH SOLI Do rozdzielania lantanowców ta metodą stosowane są następujące związki: podwójne siarczany Ln2(SO4)3K2SO42H2O do rozdzielania lantanowców na grupę cerową, irytową oraz do wydzielania irytu szczawiany Ln2(C2O4)3nH2O do rozdzielania lantanu od grupy cerowej i irytu od grupy irytowej podwójne węglany lantanowo potasowe do rozdzielania mieszaniny lantanowców na grupę cerową i irytową, a także do oddzielania toru od lantanowców chromiany Ln2(CrO4)nH2O do oddzielania irytu od lantanowców i holmu od erbu tereftalany do rozdzielania lantanowców na lekkie i ciężkie oraz do oddzielania irytu od lantanowców 16
Slide 17
STRĄCANIE ZASADOWE Dotyczy wszystkich reakcji powstawania osadów tlenków lub wodorotlenków pod wpływem dodawania lub tworzenia się w roztworze zasad. każdy osad zaczyna wytrącać się przy odpowiednim pH, które zależy od stężenia pierwiastka strącanego na efektywność rozdziału wpływa zarówno różnica zasadowości strącanych wodorotlenków jak i zasadowość odczynnika strącającego najczęściej stosowane są odczynniki strącające w postaci gazowej, co prowadzi do powolnej zmiany pH, jednakowej w całej objetości roztworu stosowane odczynniki to roztwór wody amoniakalnej, gazowy amoniak, gazowy amoniak rozcieńczony powietrzem, roztwory wodorotlenków litowców (np. NaOH), zasady organiczne (anilina) i mocznik 17
Slide 18
STRĄCANIE W OBECNOŚCI ODCZYNNIKA KOMPLEKSUJĄCEGO W metodzie tej kolejność przechodzenia lantanowców do fazy stałej zależy od dwóch czynników: od trwałości powstających kompleksów od rozpuszczalności soli lantanowców Jeżeli proces kompleksowania przedstawimy równaniem: Ln3 HxCx4 LnC xH a z drugiej strony reakcję dtrącania kwasem HA jako: αLn3 3Aα- LnαA3 To stałą trwałości kompleksu możemy zapisać wzorem: Kc [LnC] [H]x [Ln3] [Cx4] a iloczyn rozpuszczalności jako: Ks [Ln3]α [Aα-]3 18
Slide 19
CHROMATOGRAFIA JONOWYMIENNA Metoda ta jest najlepsza w otrzymywaniu lantanowców o największej czystości W procesie wymiany jonowej jony Ln3 w roztworze wymieniają się z protonem, jonem amonowym lub innym kationem z fazy jonitu żywicy jonowymiennej. Powinowactwo kationitu do jonitu zależy od wymiarów jonu i jego ładunku. Jednak przy sorpcji Ln (III) na jonicie nastepuje praktycznie ich rozdzielenie, ponieważ jonit jest zbyt mało selektywny 19
Slide 20
Gdy na kolumnę wprowadzi się czynnik kompleksujacy L, to rozdzielenie nastąpi, jeżeli stałe trwałości reakcji kompleksowania kolejnych lantanowcw Ln dla reakcji: Ln L LnL różnią się wystarczająco między sobą. Możliwe jest to gdy w układzie Ln L tworzy się tylko jeden kompleks. Jeżeli tworzą się różne kompleksy, które konkurują między sobą, to krzywe elucji poszczególnych lantanowców zachodzą na siebie, a co za tym idzie rozdzielenie nie jest efektywne. Współczynnik rozdzielnia dla pary Ln i Ln opisujemy równaniem β λLn KLn λLn KLn gdzie: λLn, λLn współczynniki podziału Ln między wodny roztwór i żywicę jonowymienną w obecności czynnika kompleksującego KLn, KLn stałe trwałości kompleksów 20
Slide 21
Jeżeli wartości współczynników podziału są do siebie zbliżone, a stałe trwałości jonów Ln są znane to w wyrażeniu na współczynnik rozdzielenia można pominąć stężenie czynnika kompleksującego. Otrzymujemy wówczas wyrażenie: β KLn KLn Do rozdzielania lantanowców tą metodą stosuje się kationity takie jak Dowex 50, Amberlit IR iGO, Zerolit 225, Wofatit KPS, a jako czynniki kompleksujące hydroksykwasy, np. kwas α hydroksyizomasłowy, mlekowy, cytrynowy oraz kwasy aminopolioctanowe, jak np. kwas nitrylotrioctowy (NTA), EDTA, kwas N hydroksyetyloetylenodiaminotrioctowy (HEDTA) 21
Slide 22
EKSTRAKCJA Metoda ta polega na rozdzielaniu lantanowców za pomocą cieczy nie mieszających się z wodą, zdolnych jednak do rozpuszczania soli Ln3. W procesie ekstrakcji kompleksy lantanowców ulegają podziałowi między fazę organiczną a fazę wodną, zgodnie z prawem Nernsta: α Corg Caq Gdzie: α współczynnik podziału Corg całkowite stężenie substancji w fazie organicznej Caq stężenie substancji w fazie wodnej 22
Slide 23
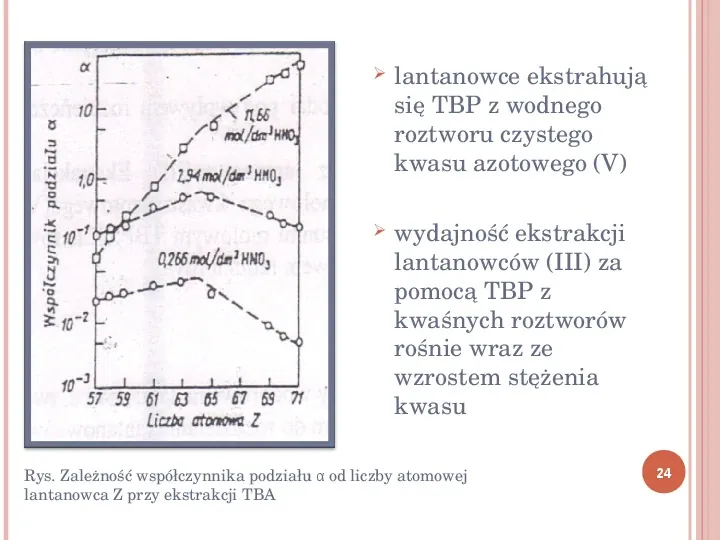
W zależności od rodzaju kompleksów tworzących się w fazie organicznej, ekstrahenty można podzielić na trzy grupy: ekstrahenty solwatujące z obojętną donorową parą elektronów (alkohole, estry, np. fosforan trin butylowy(TBP), etery, ketony) ekstrahenty o charakterze kwasowym tworzące kompleksy, tj. kwasy organofosforowe, kwasy tłuszczowe (C5 C9) ekstrahenty tworzące pary jonowe metal zasada organiczna, np. aminy wielkocząsteczkowe 23
Slide 24
lantanowce ekstrahują się TBP z wodnego roztworu czystego kwasu azotowego (V) wydajność ekstrakcji lantanowców (III) za pomocą TBP z kwaśnych roztworów rośnie wraz ze wzrostem stężenia kwasu Rys. Zależność współczynnika podziału α od liczby atomowej lantanowca Z przy ekstrakcji TBA 24
Slide 25
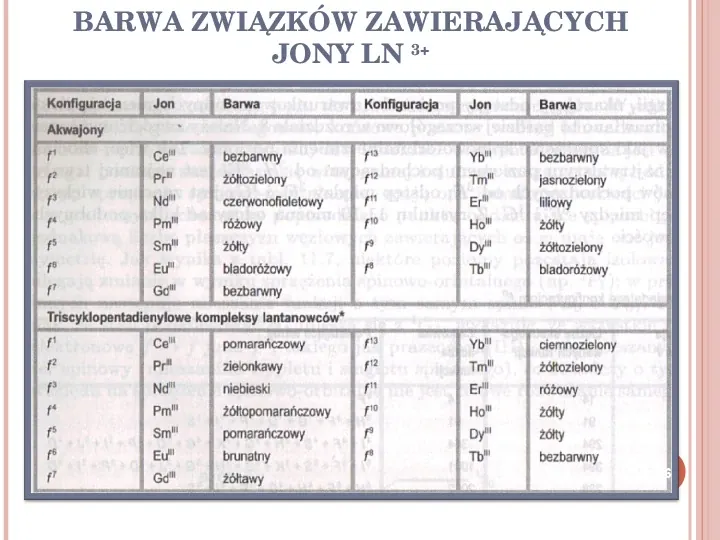
WIDMA ELEKTRONOWE LANTANOWCÓW, WŁAŚCIWOŚCI OPTYCZNE Związki większości lantanowców wykazują intensywne zabarwienie, które nie ulega zmianie w roztworach wodnych i niewodnych ani też wskutek wytworzenia się połączenia kompleksowego. 25
Slide 26
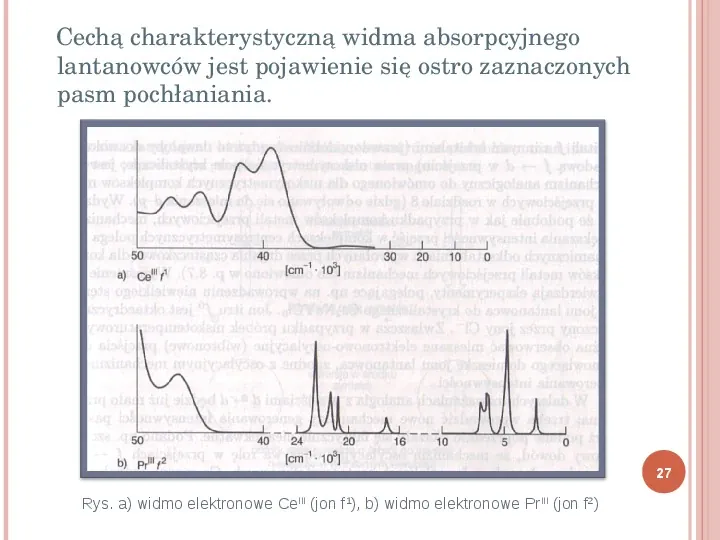
BARWA ZWIĄZKÓW ZAWIERAJĄCYCH JONY LN 3 26
Slide 27
Cechą charakterystyczną widma absorpcyjnego lantanowców jest pojawienie się ostro zaznaczonych pasm pochłaniania. 27 Rys. a) widmo elektronowe CeIII (jon f1), b) widmo elektronowe PrIII (jon f2)
Slide 28
PRZEJŚCIA F - F Przejścia te są całkowicie zlokalizowane na powłoce f i formalnie są wzbronione. Podobnie jak w przypadku przejść d d, zachodzą i powodują powstawanie wielkiej ilości słabych, ostrych pasm, występujących w zakresie od podczerwieni do obszaru widzialnego. 28
Slide 29
Pochłanianie światła przez jony lantanowców wiąże się z przejściami energetycznymi elektronów f. Elektrony te położone są tak głęboko w atomie, że jego otoczenie praktycznie nie wywiera wpływu na ich energię i tym tłumaczy się znikomy wpływ ligandów na barwę związków lantanowców. Pod tym względem różnią się one bardzo od barwnych połączeń metali przejściowych w których absorpcja światła związana jest z przejściami elektronów d, a więc elektronów położonych w bardziej zewnętrznych częściach atomu i z tego powodu zmieniających swą energię w polu ligandów. 29
Slide 30
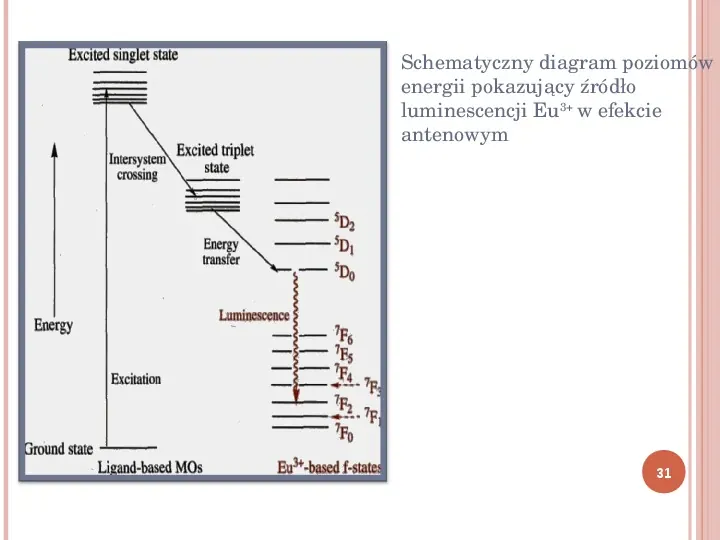
LUMINESCENCJA LANTANOWCÓW Jony wielu lantanowców fluoryzują pod wpływem promieniowania nadfioletowego, a źródłem fluorescencji są omówione wcześniej przejścia f f. Wszystkie jony Ln3 za wyjątkiem f0 La3 i f14 Lu3 wykazują luminescencję: Eu3 i Tb3 wyjątkowo silną Bezpośrednie wzbudzenie jonów Ln3 wymaga intensywnych źródeł promieniowania (lasery) ze względu na niską intensywność i ostrość pasm ff Pośrednie wzbudzenie jonów Ln3 następuje poprzez przeniesienie energii ze stanu wzbudzonego liganda, który posiada szerokie i intensywne wewnątrzligandowe pasmo absorpcji, jest to tzw. efekt antenowy 30
Slide 31
Schematyczny diagram poziomów energii pokazujący źródło luminescencji Eu3 w efekcie antenowym 31
Slide 32
Jedne z najbardziej wydajnych, stosowanych obecnie luminoforów zawierają europ (III) (emisja światła czerwonego i niebieskiego) i terb (III) (emisja światła zielonego). Matrycą , w którą wbudowywane są jony lantanowców w luminoforze, są szkłotwórcze oksoaniony borany, krzemiany, gliniany i wolframiany. Ist0otny jest także wybór substancji, ponieważ jeden z etapów z etapów procesu emisji stanowi przeniesienie pochłoniętego promieniowania nadfioletowego przez sieć krystaliczną emitera. 32
Slide 33
WŁAŚCIWOŚCI MAGNETYCZNE Jony lantanowców, z wyjątkiem jonów o konfiguracji f0 (La3, Ce4) oraz o konfiguracji f14 (Yb2, Lu3), wykazują silny paramagnetyzm. W swych właściwościach magnetycznych różnią się jednak od paramagnetycznych jonów metali zewnętrznoprzejściowych. 33
Slide 34
W jonach metali zewnętrznoprzejściowych na skutek oddziaływania elektronów d z polem krystalicznym następuje zerwanie sprzężenia LS i zamrożenie momentu orbitalnego, a obserwowany moment magnetycznym jest momentem spinowym. μef μB [4S(S1)]12 gdzie S jest wypadkową spinową liczbą kwantową 34
Slide 35
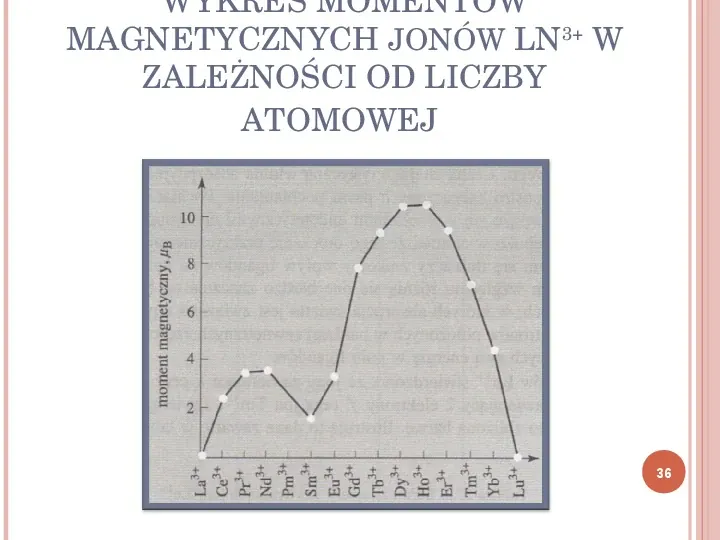
W jonach lantanowców elektrony f są osłaniane przez elektrony w bardziej zewnętrznych powłokach i ich oddziaływanie z polem krystalicznym jest znacznie słabsze. W rezultacie sprzężenie LS zostaje zachowane, a całkowity moment magnetyczny jonów lantanowców jest sumą momentu spinowego i orbitalnego. Wartości μef dla jonów lantanowców 35
Slide 36
WYKRES MOMENTÓW MAGNETYCZNYCH JONÓW LN3 W ZALEŻNOŚCI OD LICZBY ATOMOWEJ 36
Slide 37
BIBLIOGRAFIA 1. A. F. Williams, Chemia nieorganiczna. Podstawy teoretyczne, Państwowe Wydawnictwo Naukowe, Warszawa 1986 2. S. F. A. Kettle, Fizyczna chemia nieorganiczna na przykładzie chemii koordynacyjnej, Wydawnictwo Naukowe PWN, Warszawa 1999 3. A. Bielański, Podstawy chemii nieorganicznej część 2, Wydawnictwo Naukowe PWN, Warszawa 2005 37
Slide 38
DZIĘKUJEMY ZA UWAGĘ 38
Dane:
- Liczba slajdów: 38
- Rozmiar: 14.39 MB
- Ilość pobrań: 137
- Ilość wyświetleń: 6212