Zobacz slidy
Treść prezentacji
Slide 1
BARWIENIE PŁOMIENIA
Slide 2
BARWIENIE PŁOMIENIA PALNIKA Barwienie płomienia palnika technika stosowana w chemicznej analizie jakościowej polegająca na umieszczaniu próbki w płomieniu palnika i obserwowaniu zmian zabarwienia płomienia. W wysokiej temperaturze związki niektórych matali wyparowują, a ich pary pobudzone do świecenia zabarwiają płomień palnika w charakterystyczny dla siebie sposób. Zabarwienie to wynika z faktu jonizacji metali, czyli powstawania odpowiednich kationów, w obecności których płomień palnika przybiera określoną barwę. W wielu przypadkach barwa ta jest na tyle charakterystyczna, że w połączeniu z innymi technikami analitycznymi umożliwia niemal stuprocentową pewność obecności danego metalu w próbce.
Slide 3
PIERWIASTKI BARWIĄCE PŁOMIEŃ sód żółty, potas fioletowy, liliowy, miedz niebieski, stront karminowoczerwony, wapń ceglastoczerwony lub pomarańczowy, bar zielony, jasnozielony, biały, lit różowoczerwony, ciemnoliliowy, fioletowy (inny niż potas). Inne pierwiastki barwiące płomień (ale rzadko lub wcale wykorzystywane) to: bor zielony, rubid żółto fioletowy, cez fioletowoniebieski
Slide 4
ZWIĄZKI SODU BARWIĄCE PŁOMIEŃ sole wapnia barwią płomień na ceglastoczerwony, sole strontu barwią płomień na czerwono, sole litu barwią płomień na karminowo, sole indu barwią płomień na indygowy (nazwa pierwiastka pochodzi od tego zjawiska), sole sodu barwią płomień na żółty, sole miedzi barwią płomień na zielony, sole potasu barwią płomień na fioletowy, sole rubidu i cezu barwią płomień na fioletowo różowy, sole baru i boru barwią na kolor jasno zielony, sole cyny, bizmutu, antymonu, ołowiu, arsenu barwią na kolor niebieski, sole jonem chloru barwią na kolor żółty
Slide 5
KATIONY BARWIĄCE PŁOMIEŃ Kationy metali I grupy głównej Li barwi płomień na karminowy, ciemnoczerwony i wiśniowoczerwony Na barwi płomień na intensywnie żółty K barwi płomień na różowy i różowo fioletowy Rb barwi płomień na purpurowy i jasnofioletowy Cs barwi płomień na niebieski i niebieskofioletowy Kationy metali II grupy głównej Ca2 barwi płomień na ceglastoczerwony Sr2 barwi płomień na karminowoczerwony Ba2 barwi płomień na jasnozielony i żółtozielony Ra2 barwi płomień na karminowoczerwony Kationy lantanowców Eu3 barwi płomień na czerwony Kationy metali XI grupy pobocznej Cu2 (halogenki) barwi płomień na niebieskozielony Cu2 (inne sole) barwi płomień na zielony Cu barwi płomień na niebieski Kationy metali III grupy głównej Ga3 barwi płomień na fioletowy i niebieskofioletowy In3 barwi płomień na indygowy Tl barwi płomień na zielony
Slide 6
SPALANIE Spalanie reakcja chemiczna przebiegająca między materiałem palnym lub paliwem a utleniaczem, z wydzieleniem ciepła i światła. Paliwa i utleniacze mogą występować w trzech stanach skupienia gazowym, ciekłym i stałym. Powszechnie dostępnym utleniaczem gazowym jest tlen zawarty w powietrzu. Utleniacze ciekłe i stałe są stosowane w silnikach rakietowych. Są trzy typy zapoczątkowania reakcji spalania: zapłon punktowy bodziec energetyczny (np. zapałka, iskra itp.) samozapłon ciągły bodziec energetyczny (np. strumień ciepła elementów grzejnych) samozapalenie proces samorzutnego zapoczątkowania reakcji spalania przy pomocy przemian zachodzących w samym materiale na drodze fizycznej i chemicznej.
Slide 7
SPALANIE PIERWIASTKÓW spalanie litu spalanie strontu
Slide 8
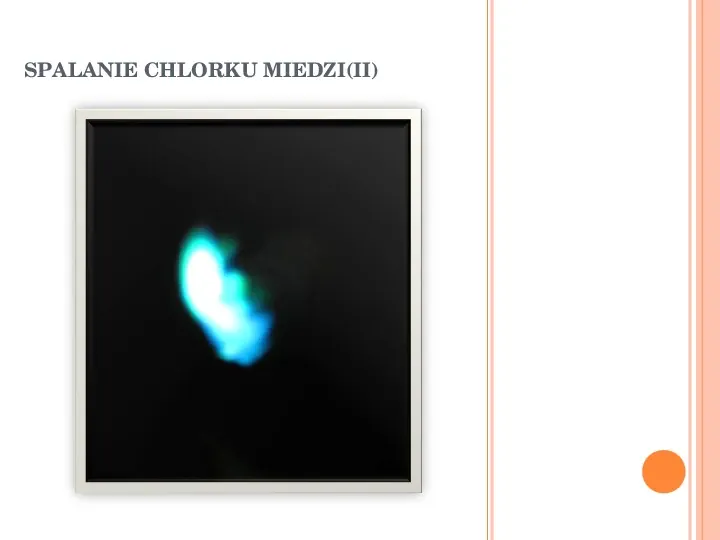
SPALANIE CHLORKU MIEDZI(II)
Slide 9
WZBUDZANIE ATOMÓW Wzbudzanie atomu to przeskok elektronu na powłokę wyższą Wzbudzenie jest procesem nietrwałym. Elektron wraca do stanu podstawowego, oddając taką samą porcję energii, jaką wcześniej dostał. Łatwiej wzbudzić elektron z drugiej powłoki, niż z pierwszej.
Slide 10
STAN WZBUDZONY Stan wzbudzony w mechanice kwantowej jest to stan związany układu kwantowo mechanicznego, mający większą energię niż stan podstawowy. W fizyce atomowej stan wzbudzony jest pojęciem odnoszącym się do atomów lub cząsteczek. O ile w stanie podstawowym atomu, elektrony zapełniają orbitale zgodnie z Regułą Hunda, o tyle w stanie wzbudzonym mogą występować np. dwa orbitale z niesparowanymi elektronami.
Slide 11
TĘCZA Tęcza zjawisko optyczne, łuk na niebie składający się z siedmiu kolorów spektrum ( widma optycznego) w postaci wstęg. Powstaje na skutek załamania się, odbicia i rozszczepienia promieni słonecznych w kroplach deszczu lub mgły. Zjawisko to zostało opisane przez Teodoryka z Fryburga w XIV wieku.
Slide 12
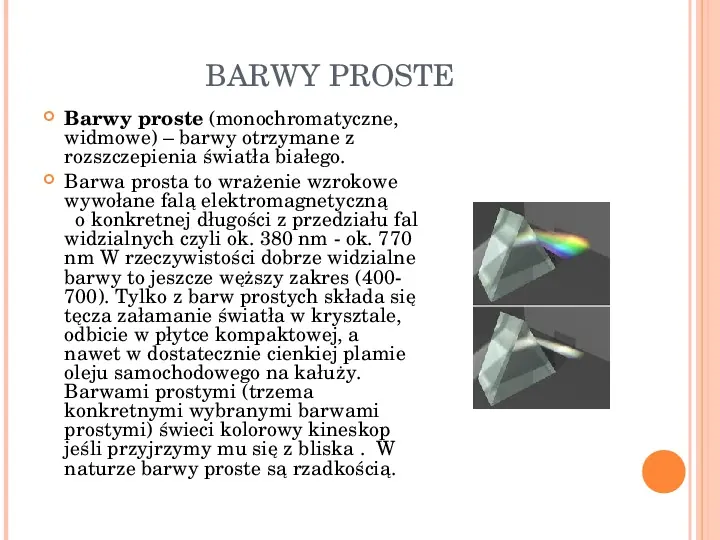
TĘCZA Pryzmat Zjawisko dyspersji światła Jak wiemy światło rozchodzi się z różną prędkością w zależności od tego w jakim ośrodku się porusza. Najszybciej porusza się w próżni gdzie jego prędkość w przybliżeniu wynosi 300000 kms. Jednakże prędkość światła przy przechodzeniu prze określony ośrodek zależy także o długości fali światła, czyli od jego częstotliwości, jest to tzw. zjawisko dyspersji światła. Najprościej zaobserwować dyspersję światła, poprzez oświetlenie światłem białym pryzmatu. Jeśli ustawimy za pryzmatem ekran, zaobserwujemy powstanie na nim pięknej kolorowej tęczy. Powstała tęcza, wynika bezpośrednio z różnicy współczynników załamania dla poszczególnych barw składowych. Najmniejszy współczynnik załamania ma barwa czerwona, i dlatego też jej kąta załamania jest najmniejszy. Natomiast najbardziej odchyla się od początkowego kierunku padania barwa fioletowa, gdyż w wyniku dyspersji, współczynnik załamania dla tej barwy jest największy.
Slide 13
ŚWIATŁO BIAŁE Światło białe jest światłem złożonym, składa się z wielu promieni różniących się od siebie długością fali, a co za tym idzie częstotliwością. Z inną prędkością będzie się poruszała składowa czerwona światła, a z inną składowa fioletowa. Tylko w próżni wszystkie składowe będą się poruszać z jednakowymi prędkościami.
Slide 14
BARWY PROSTE Barwy proste (monochromatyczne, widmowe) barwy otrzymane z rozszczepienia światła białego. Barwa prosta to wrażenie wzrokowe wywołane falą elektromagnetyczną o konkretnej długości z przedziału fal widzialnych czyli ok. 380 nm ok. 770 nm W rzeczywistości dobrze widzialne barwy to jeszcze węższy zakres (400 700). Tylko z barw prostych składa się tęcza załamanie światła w krysztale, odbicie w płytce kompaktowej, a nawet w dostatecznie cienkiej plamie oleju samochodowego na kałuży. Barwami prostymi (trzema konkretnymi wybranymi barwami prostymi) świeci kolorowy kineskop jeśli przyjrzymy mu się z bliska . W naturze barwy proste są rzadkością.
Slide 15
DOŚWIADCZENIE
Slide 16
ŹRÓDŁA: ZDJĘCIA PRYZMATU I SPALANIA LITU I STRONTU Z INTERNETU ZDJĘCIA DOŚWIADCZENIA WYKONANE PODCZAS SZKOLNEGO KOŁA NAUKOWEGO DEFINICJE Z WIKIPEDII
Dane:
- Liczba slajdów: 16
- Rozmiar: 3.11 MB
- Ilość pobrań: 375
- Ilość wyświetleń: 10968