Zobacz slidy
Treść prezentacji
Slide 1
CHEMICZNE ŹRÓDŁA PRĄDU ELEKTRYCZNEG O
Slide 2
Chemiczne źródła prądu Chemiczne źródła prądu elektrycznego to źródła, w których zachodzi reakcja chemiczna, wynikiem której jest wytworzenie energii elektrycznej.
Slide 3
Podział chemicznych źródeł prądu Źródła dzielimy na źródła pierwotne (ogniwa), które dostarczają energii w wyniku reakcji chemicznych zużywających ich elementy i składniki chemiczne w sposób nieodwracalny
Slide 4
Podział chemicznych źródeł prądu Drugim rodzajem są źródła wtórne (akumulatory), które oddają energię dostarczoną im w czasie ładowania.
Slide 5
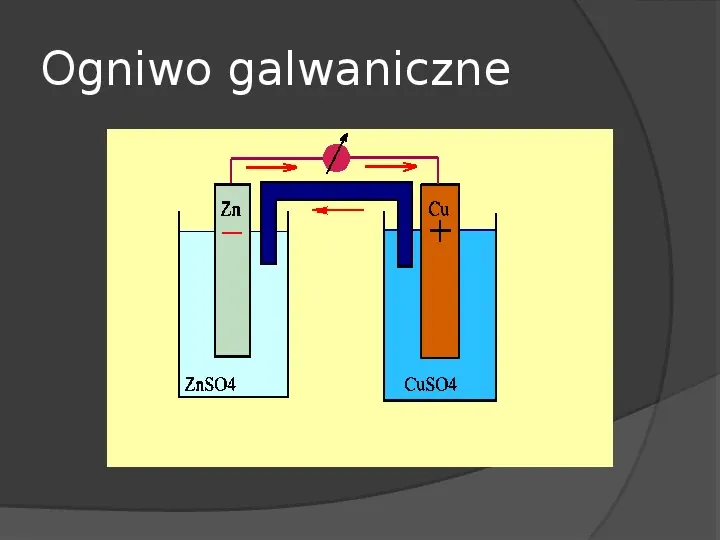
Ogniwo galwaniczne Do obydwu źródeł należy ogniwo galwaniczne, będące dziełem Alessandra Volty, który udowodnił na podstawie doświadczeń Luigiego Galvaniego, że powstawanie prądu nie jest związane z organizmem żywym, ale metalami zanurzonymi w elektrolicie.
Slide 6
Alessandro Volta Włoski fizyk, wynalazca, konstruktor . Urodzony 18 lutego 1745 roku . Już w młodości wykazywał duże zainteresowanie fizyką, a zwłaszcza elektrycznością. W roku 1774 skonstruował elektrofor, umożliwiający elektryzowanie ciał. W roku 1800 skonstruował ogniwo Volty poprzez zanurzenie płytek srebra i cynku w słonej wodzie, a w 1801 zaprezentował przed samym Napoleonem stos Volty. Zmarł 5 marca 1827. Na jego cześć jednostkę napięcia elektrycznego nazwano wolt.
Slide 7
Ogniwo galwaniczne
Slide 8
BATERIE CYNKOWO-WĘGLOWE
Slide 9
Pierwotne źródła Źródłami pierwotnymi są różnego rodzaju baterie, w których zostały wykorzystane ogniwa. Najpopularniejszym ogniwem galwanicznym jest ogniwo Leclanchego, występujące np. w bateriach cynkowowęglowych (tzw. paluszkach).
Slide 10
Georges Leclanche Chemik francuski. Urodził się i zmarł w Paryżu. W roku 1867 porzucił dotychczasowe zajęcie i poświęcił się wyłącznie pracom nad wynalazkami. Siedemnaście lat po uzyskaniu tytułu inżyniera, to znaczy w roku 1877, wynalazł ogniwo galwaniczne zwane ogniwem Leclanchego. Zastosował w nim pręt węglowy, który pełnił funkcję elektrody dodatniej.
Slide 11
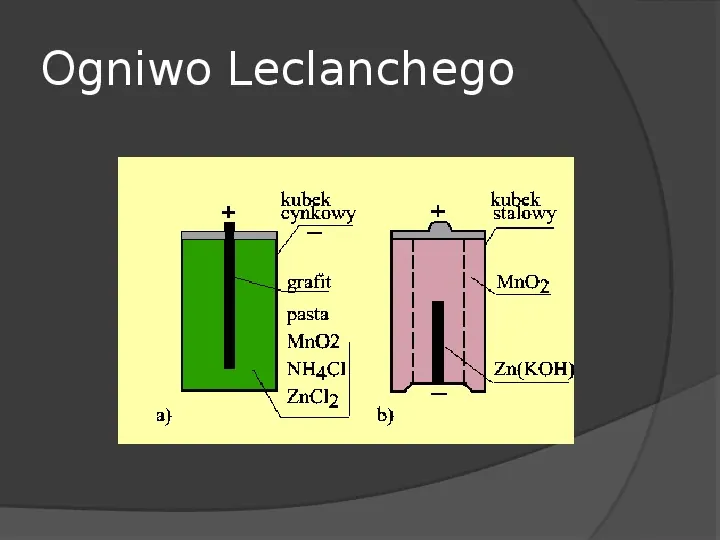
Ogniwo Leclanchego
Slide 12
Baterie cynkowowęglowe Bateria taka składa się z kubka cynkowego, będące jednocześnie jego obudową i elektrodą ujemną. Wewnątrz kubka jest elektrolit w postaci pasty złożonej z chlorku amonowego, wody i chlorku cynkowego. Pręt węglowy zaopatrzony jest na końcu w przykrywkę mosiężną dla lepszego kontaktu z prętem węglowym.
Slide 13
Baterie cynkowowęglowe
Slide 14
Plusy i minusy Wadą ogniw cynkowo-węglowych jest, że są mało odporne na długie przechowywanie a po dużym rozładowaniu mogą wylać elektrolit. Ogólnie ogniwa pierwotne służą do jednorazowego użytku ( aż do wyczerpania ). Jednakże ze względu na ich cenę są najpopularniejszymi bateriami.
Slide 15
BATERIE ALKALICZNE
Slide 16
Baterie alkaliczne Podobne do baterii cynkowo-węglowych są baterie alkaliczne, lecz zamiast elektrolitu użyto roztworu o odczynie zasadowym (alkalicznym), więc stąd ich nazwa. Użyto w nich czystsze reagenty na elektrody, co daje im większą pojemność i trwałość podczas przechowywania.
Slide 17
Baterie alkaliczne Bateria alkaliczna została wynaleziona przez amerykańskiego chemika Lewisa Urryego w 1959 w firmie Eveready Battery . Współczesne tego typu baterie zostały unowocześnione i mogą wytrzymać do 40 razy dłużej.
Slide 18
Bateria alkaliczna
Slide 19
Zasada działania. Zasada działania baterii polega na reakcji chemicznej, która zachodzi pomiędzy cynkiem a tlenkiem manganu(IV) (ZnMnO2).
Slide 20
Baterie alkaliczne Niestety, cena baterii alkalicznych jest dużo większa niż paluszków, lecz można je obciążyć dużymi prądami, bez dużej utraty pojemności i spadku napięcia. Najlepiej nadają się do odtwarzaczy MP3, aparatów cyfrowych, latarek o dużej mocy, pilotów zdalnego sterownia.
Slide 21
Wtórne źródła energii Z wtórnych źródeł zasilania stosuje się akumulatory kadmowo-niklowe, kwasowo-ołowiowe, litowe, niklowożelazowe itd. Akumulatory w przeciwieństwie do baterii, możemy naładować.
Slide 22
AKUMULATO R OŁOWIOWY
Slide 23
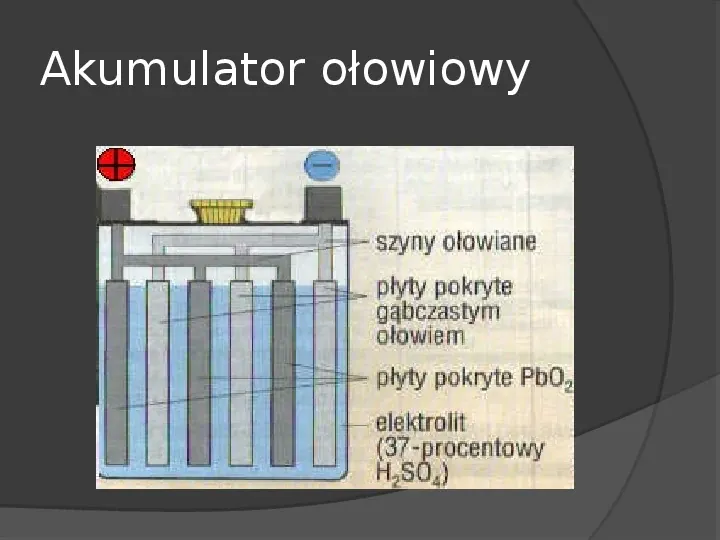
Akumulator ołowiowy Akumulator ołowiowy został wynaleziony przez francuskiego fizyka Gastona Planté w 1859 r. Mimo iż ma wiele wad, jest wciąż najbardziej popularnym rodzajem akumulatorów elektrycznych. Stanowi ok. 60 ogólnej ilości, wszystkich akumulatorów znajdujących się w sprzedaży.
Slide 24
Akumulator ołowiowy
Slide 25
Działanie Na płytach ujemnych tworzy się siarczan ołowiu, a na płytach dodatnich przebiega reakcja: PbO2H2H2S04H2SO42H20, z której wywiązuje się też siarczan ołowiu. Tak powstaje prąd w akumulatorze ołowiowym.
Slide 26
Plusy i minusy Elektrody zbudowane są z ołowiu, co korzystnie wpływa na procesy ładowania oraz rozładowania, ale samo urządzenie jest bardzo ciężkie i jest wrażliwe na wstrząsy. Charakterystyczna dla tego typu akumulatorów jest duża odporność na skrajne warunki zewnętrzne, duża ilość cykli ładowania i rozładowania.
Slide 27
Zastosowanie Akumulatory ołowiowe stosuje się do zasilania rozrusznika w samochodzie, lub jako źródło mocy zapasowej oraz znalazł dzięki swej wytrzymałości zastosowanie w militarii.
Slide 28
AKUMULATOR NIKLOWO-KADMOWY
Slide 29
Akumulator niklowo-kadmowy Kolejnym rodzajem akumulatora jest akumulator niklowo-kadmowy, wynaleziony przez Thomasa Alva Edisona. Pierwsze tego typu akumulatory w postaci baterii AA miały pojemność około 500 mAh.
Slide 30
Akumulator niklowo-kadmowy
Slide 31
Budowa Ogniwo zbudowane jest z elektrody ujemnej z kadmu i dodatniej z niklu. Elektrolitem jest wodny roztwór wodorotlenku potasu. W celu zapobieżenia zwarciu, elektrody są przedzielone porowatym separatorem, wykonanym najczęściej z tworzywa sztucznego.
Slide 32
Ładowanie Akumulatory niklowo - kadmowe ładuje się stałym prądem. W czasie ładowania należy doprowadzać więcej energii niż otrzymuje się przy wyładowaniu. Mają bardzo korzystną właściwość, polegająca na możliwości przyjęcia dużego ładunku w krótkim czasie. Im krótszy jest czas ładowania, tym ściślejsza musi być kontrola ładowania.
Slide 33
Plusy i minusy Tego typu akumulator jest do dziś najtrwalszym ogniwem miniaturowym, ma też niską cenę, jego zaletą jest waga, czas życia, lecz występuje w nim uciążliwy efekt pamięci.
Slide 34
Efekt pamięci Chodzi o to, że powinien być rozładowywany i ładowany w pełnych cyklach, czyli zaleca się pełne rozładowywanie, a po rozładowaniu należy akumulator niezwłocznie naładować nie pozostawiając go na dłużej w stanie rozładowanym.
Slide 35
Zakończenie Chemiczne źródła prądu miały duży wpływ na życie człowieka i jego obcowanie z techniką. Zarówno źródła pierwotne jak i wtórne występują w wielu urządzeniach, z którymi człowiek ma do czynienia każdego dnia. Cały czas ten przemysł się rozwija, pojawiają się coraz to nowsze, ulepszone typy poprzedników.
Slide 36
DZIĘKUJĘ ZA UWAGĘ
Dane:
- Liczba slajdów: 36
- Rozmiar: 0.24 MB
- Ilość pobrań: 4049
- Ilość wyświetleń: 25863