Zobacz slidy
Treść prezentacji
Slide 1
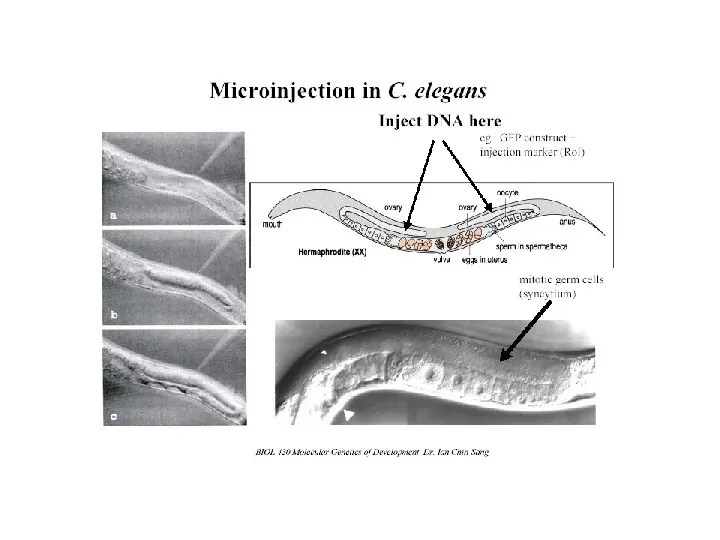
Badania z użyciem transgenicznych zwierząt: lokalizacja ekspresji genu (konstrukty z genem reporterowym i regionem regulatorowym badanego genu) określenie funkcji genu nadekspresja lub ektopowa (w nienormalnym m-scu) ekspresja genu nokaut genu - inaktywacja genu przez rekombinację homologiczną analiza genetycznego mozaicyzmu (badanie funkcji genu później w rozwoju w sytuacji gdy mutanty są letalne w zarodku, określanie, w których komórkach jego ekspresja
Slide 3
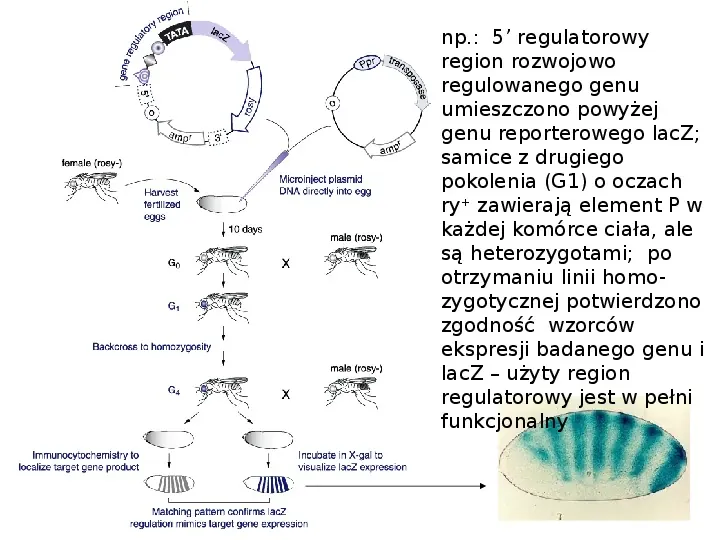
Tworzenie transgenicznych Drosophila transformacja z udziałem elementu P element P - transpozon, element ruchomy - 2,9 kpz, zawiera gen transpozazy otoczony przez odwrócone powtórzenia o długości 31 pz (dzikie drozofile zawierają ok. 30-50 rozproszonych kopii elementów P), transkrypt transpozazy ulega alternatywnemu splicingowi każde DNA umieszczone pomiędzy odwróconymi powtórzeniami będzie się zachowywało jak transpozon o ile transpozaza jest aktywna; transpozaza działa w pozycji trans
Slide 4
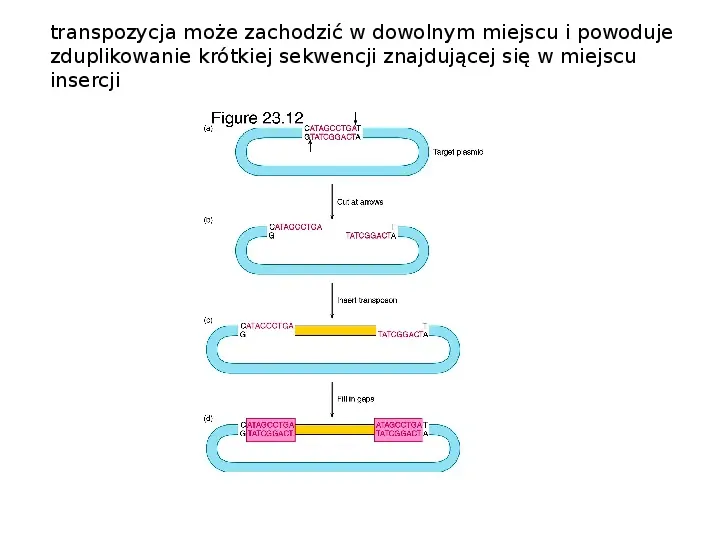
transpozycja może zachodzić w dowolnym miejscu i powoduje zduplikowanie krótkiej sekwencji znajdującej się w miejscu insercji
Slide 5
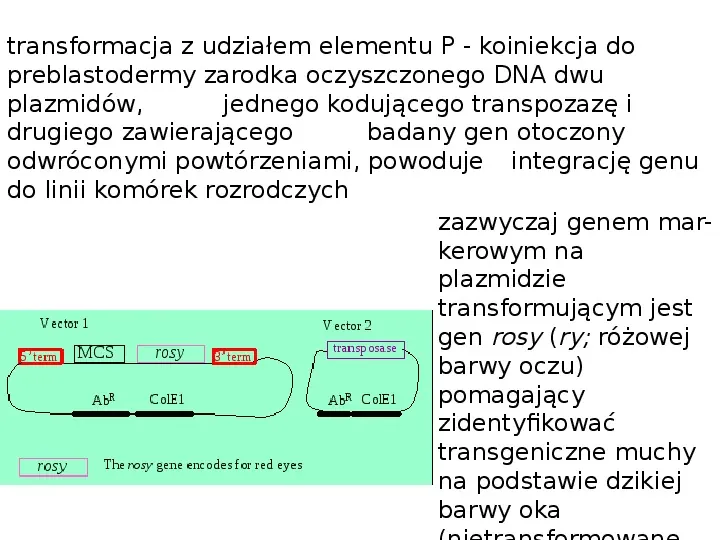
transformacja z udziałem elementu P - koiniekcja do preblastodermy zarodka oczyszczonego DNA dwu plazmidów, jednego kodującego transpozazę i drugiego zawierającego badany gen otoczony odwróconymi powtórzeniami, powoduje integrację genu do linii komórek rozrodczych zazwyczaj genem markerowym na plazmidzie transformującym jest gen rosy (ry; różowej barwy oczu) pomagający zidentyfikować transgeniczne muchy na podstawie dzikiej barwy oka
Slide 7
np.: 5 regulatorowy region rozwojowo regulowanego genu umieszczono powyżej genu reporterowego lacZ; samice z drugiego pokolenia (G1) o oczach ry zawierają element P w każdej komórce ciała, ale są heterozygotami; po otrzymaniu linii homozygotycznej potwierdzono zgodność wzorców ekspresji badanego genu i lacZ użyty region regulatorowy jest w pełni funkcjonalny
Slide 8
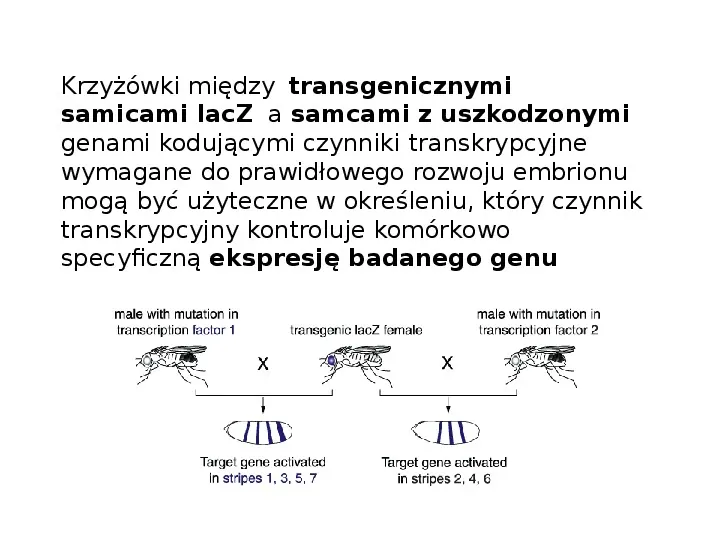
Krzyżówki między transgenicznymi samicami lacZ a samcami z uszkodzonymi genami kodującymi czynniki transkrypcyjne wymagane do prawidłowego rozwoju embrionu mogą być użyteczne w określeniu, który czynnik transkrypcyjny kontroluje komórkowo specyficzną ekspresję badanego genu
Slide 9
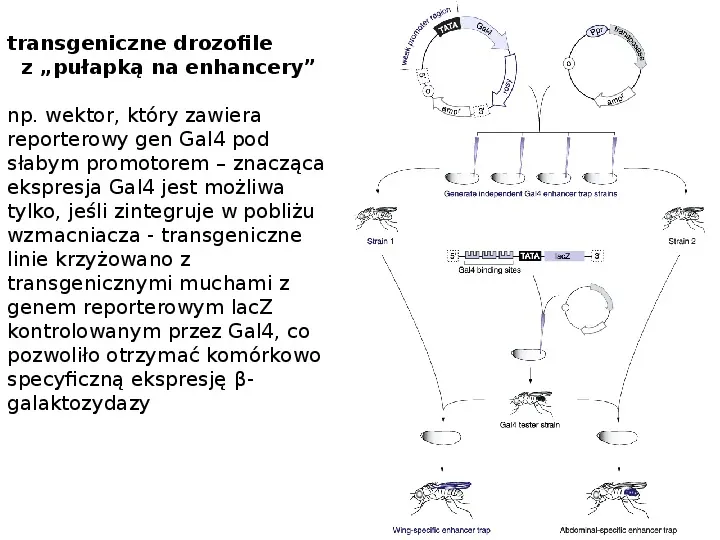
transgeniczne drozofile z pułapką na enhancery np. wektor, który zawiera reporterowy gen Gal4 pod słabym promotorem znacząca ekspresja Gal4 jest możliwa tylko, jeśli zintegruje w pobliżu wzmacniacza - transgeniczne linie krzyżowano z transgenicznymi muchami z genem reporterowym lacZ kontrolowanym przez Gal4, co pozwoliło otrzymać komórkowo specyficzną ekspresję βgalaktozydazy
Slide 10
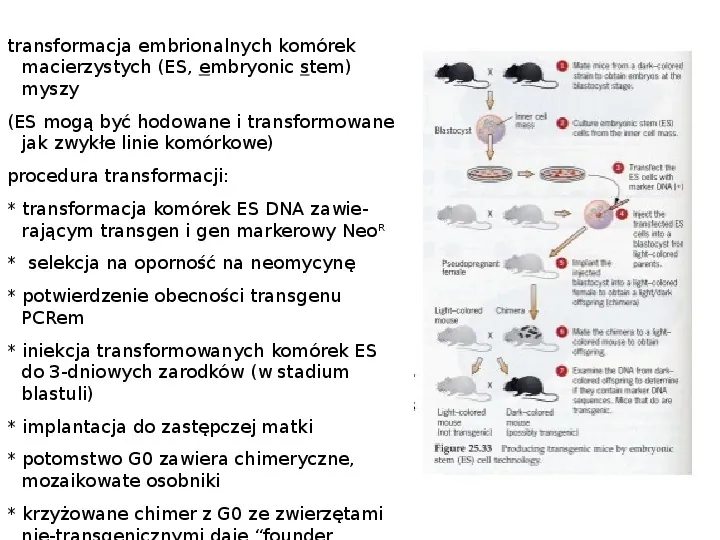
transgeniczne ssaki - technologia transgeniczna iniekcja obcego DNA do zapłodnionych oocytów zwykle transgeniczny osobnik zawiera w pojedynczym (rzadko podwójnym) chromosomowym miejscu integracji wiele (50) prostych powtórzeń transgenu, które będą mendlowsko przekazywane 50 potomstwa infekcja lub iniekcja zrekombinowanego, defektywnego w replikacji retrowirusa z genem reporterowym do wczesnych zarodków iniekcja genetycznie zmodyfikowanych zarodkowych komórek macierzystych ES (rozmnażające się in vitro totipotencjalne komórki z wewnętrznej masy komórek 3,5dniowego zarodka) do blastocysty, a następnie reimplantacja zarodka w pseudociężarnej samicy, powstaje chimera złożona z komórek blastocysty i implantowanych komórek ES, często dwubarwna w dwu ostatnich metodach początkowo powstają osobniki częściowo transgeniczne, mozaiki komórek
Slide 11
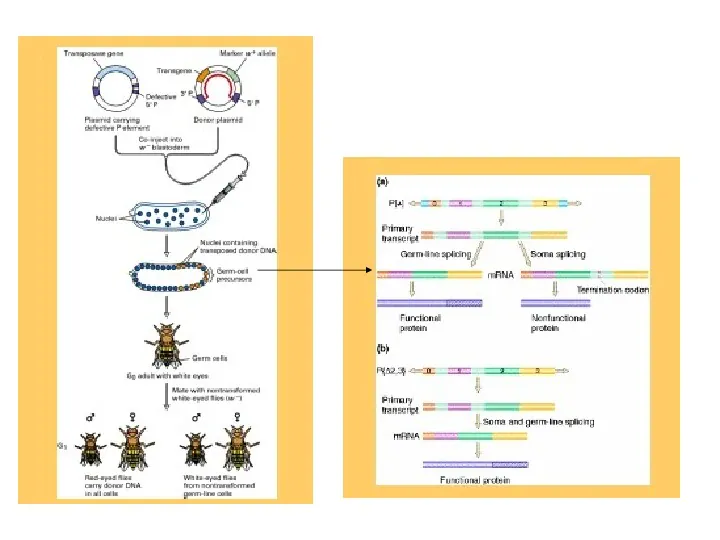
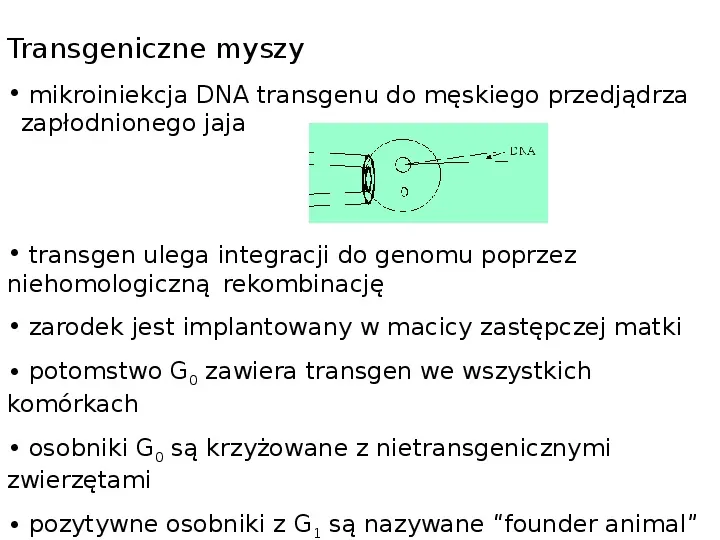
Transgeniczne myszy mikroiniekcja DNA transgenu do męskiego przedjądrza zapłodnionego jaja transgen ulega integracji do genomu poprzez niehomologiczną rekombinację zarodek jest implantowany w macicy zastępczej matki potomstwo G0 zawiera transgen we wszystkich komórkach osobniki G0 są krzyżowane z nietransgenicznymi zwierzętami pozytywne osobniki z G1 są nazywane founder animal
Slide 12
Iniekcja do przedjądrza męskiego używa się samic z dwu linii: superowulujące pod wpływem podanych hormonów będą dawczyniami zapłodnionych jaj pseudociężarne będą matkami zastępczymi dla zarodków po iniekcji oraz samców z dwu linii: z tej samej linii co superowulujące samice będą z nimi kopulować by powstały zarodki z innej linii, poddane wazektomii, będą kopulować z pseudociężarnymi samicami
Slide 13
Iniekcja do przedjądrza męskiego stymulację hormonalną samic dawczyń rozpoczyna się 3 dni przed pozyskaniem zarodków ostatniej nocy umieszcza się w tej samej klatce samice dawczynie i samców dawców następnego ranka samicom usuwa się jajniki, jajowody i macicę izoluje się jajowody z częścią macicy, a z nich masę ziarnistą otaczającą zapłodnione jaja masę ziarnistą umieszcza się w kropli pożywki z hialuronidazą i po uwolnieniu zarodków selekcjonuje się je
Slide 14
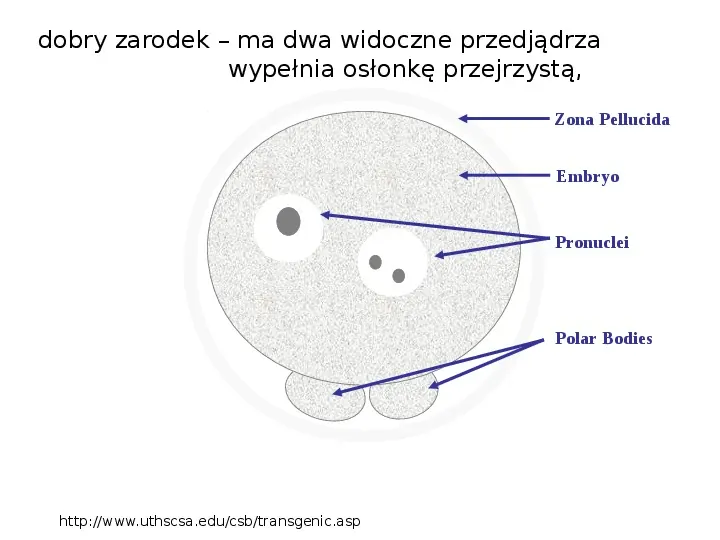
dobry zarodek ma dwa widoczne przedjądrza wypełnia osłonkę przejrzystą, Zona Pellucida Embryo Pronuclei Polar Bodies http:www.uthscsa.educsbtransgenic.asp
Slide 15
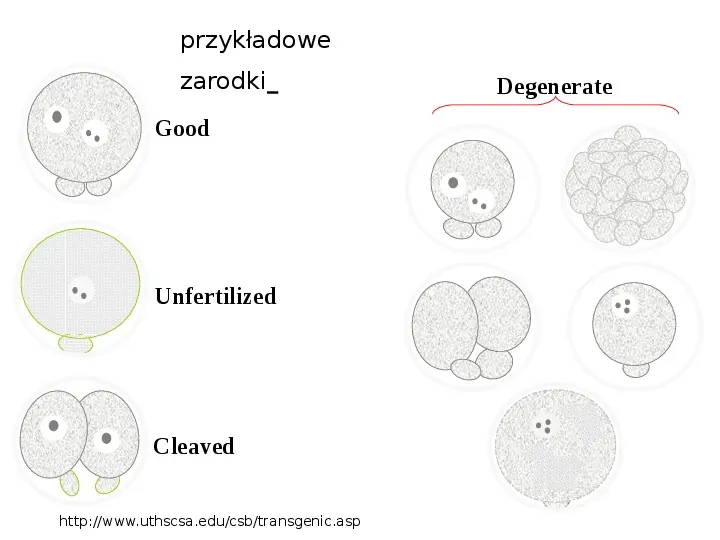
przykładowe zarodki Good Unfertilized Cleaved http:www.uthscsa.educsbtransgenic.asp Degenerate
Slide 16
Photograph showing examples of good and degenerate embryos http:www.uthscsa.educsbtransgenic.asp
Slide 17
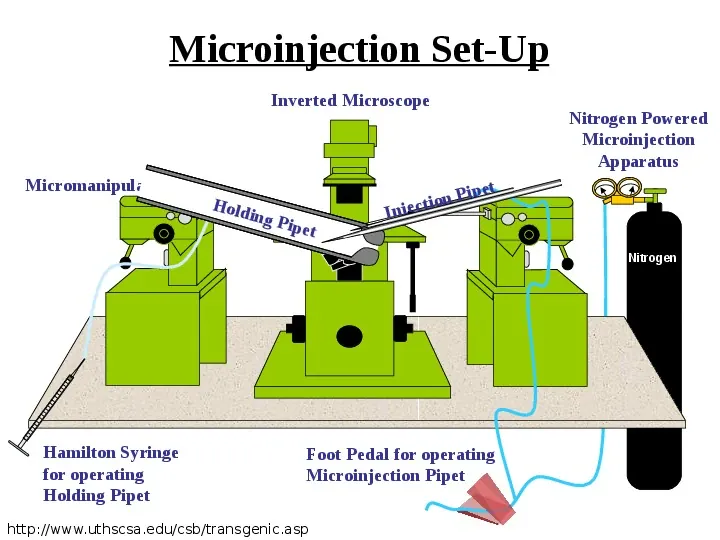
Microinjection Set-Up Inverted Microscope Micromanipulator Hold ing P ip et Nitrogen Powered Microinjection Apparatus ipet P n o ti Injec Nitrogen Hamilton Syringe for operating Holding Pipet Foot Pedal for operating Microinjection Pipet http:www.uthscsa.educsbtransgenic.asp
Slide 18
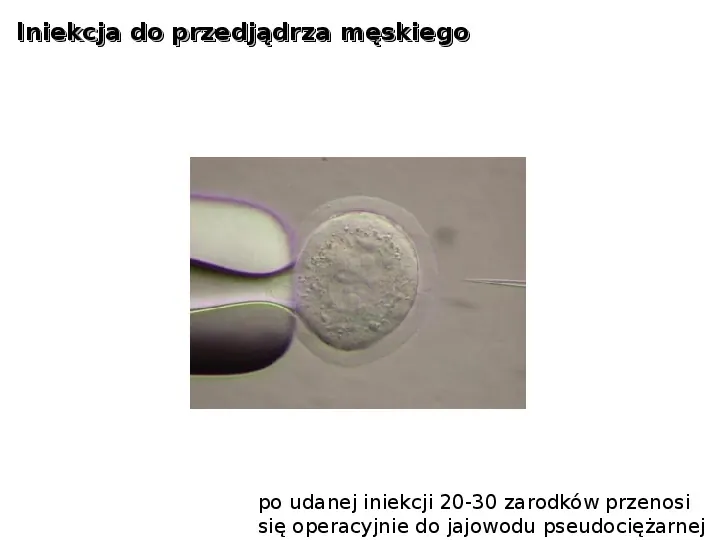
Iniekcja do przedjądrza męskiego po udanej iniekcji 20-30 zarodków przenosi się operacyjnie do jajowodu pseudociężarnej
Slide 19
Iniekcja do przedjądrza męskiego ZALETY ekspresja transgenu w wielu tkankach i stadiach rozwojowych możliwość nadekspresji WADY - przypadkowe miejsca insercji -- wiele kopii --- insercyjna inaktywacja
Slide 20
transformacja embrionalnych komórek macierzystych (ES, embryonic stem) myszy (ES mogą być hodowane i transformowane jak zwykłe linie komórkowe) procedura transformacji: transformacja komórek ES DNA zawierającym transgen i gen markerowy NeoR selekcja na oporność na neomycynę potwierdzenie obecności transgenu PCRem iniekcja transformowanych komórek ES do 3-dniowych zarodków (w stadium blastuli) implantacja do zastępczej matki potomstwo G0 zawiera chimeryczne, mozaikowate osobniki krzyżowane chimer z G0 ze zwierzętami
Slide 21
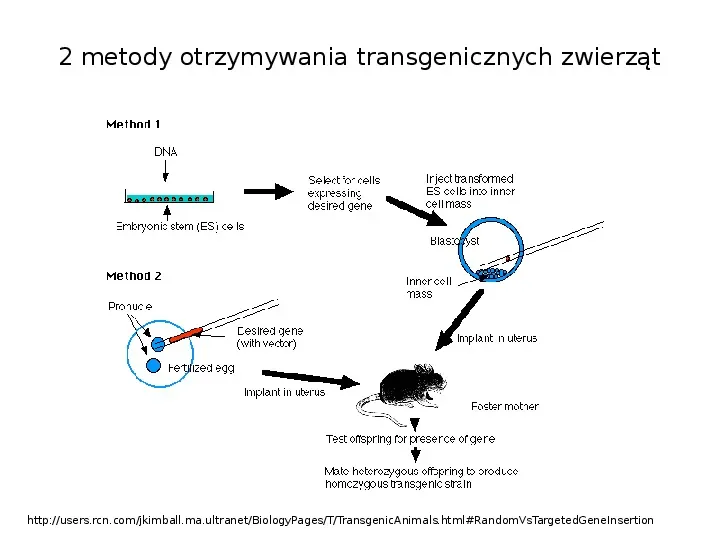
2 metody otrzymywania transgenicznych zwierząt http:users.rcn.comjkimball.ma.ultranetBiologyPagesTTransgenicAnimals.htmlRandomVsTargetedGeneInsertion
Slide 22
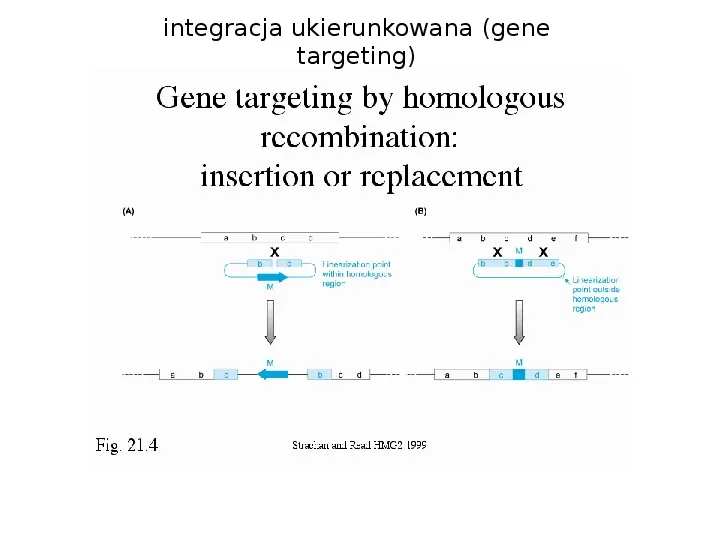
integracja ukierunkowana (gene targeting)
Slide 23
metoda mutagenezy in vivo genu docelowego (gene targeting) wprowadzenie zmutowanej lub poprawnej (gene therapy) kopii genu lub stworzenie osobników z inaktywacją genu (gene knockout) technologia antysensowna (gene silencing)
Slide 24
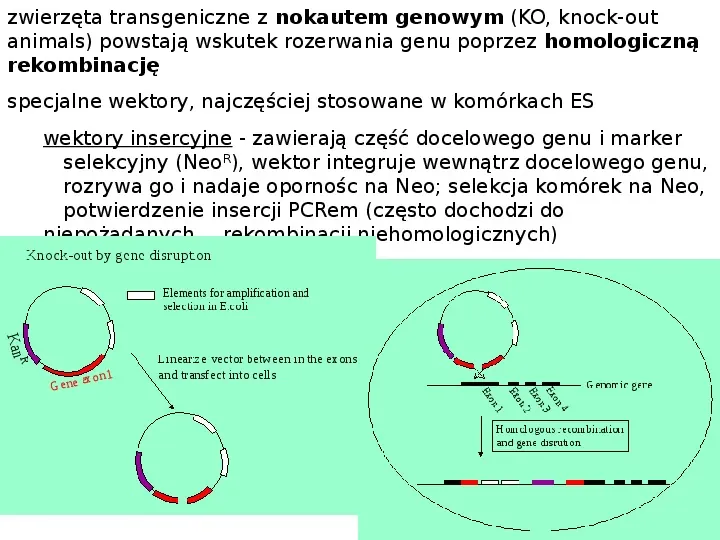
zwierzęta transgeniczne z nokautem genowym (KO, knock-out animals) powstają wskutek rozerwania genu poprzez homologiczną rekombinację specjalne wektory, najczęściej stosowane w komórkach ES wektory insercyjne - zawierają część docelowego genu i marker selekcyjny (NeoR), wektor integruje wewnątrz docelowego genu, rozrywa go i nadaje opornośc na Neo; selekcja komórek na Neo, potwierdzenie insercji PCRem (często dochodzi do niepożądanych rekombinacji niehomologicznych)
Slide 25
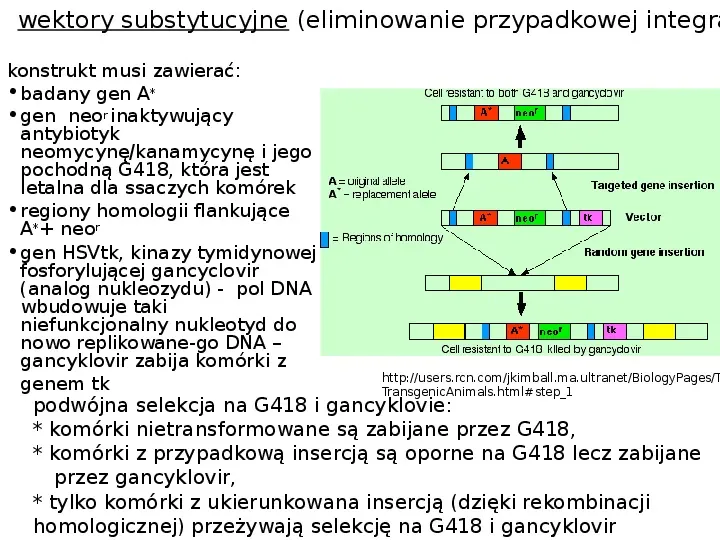
wektory substytucyjne (eliminowanie przypadkowej integra konstrukt musi zawierać: badany gen A gen neor inaktywujący antybiotyk neomycynękanamycynę i jego pochodną G418, która jest letalna dla ssaczych komórek regiony homologii flankujące A neor gen HSVtk, kinazy tymidynowej fosforylującej gancyclovir (analog nukleozydu) - pol DNA wbudowuje taki niefunkcjonalny nukleotyd do nowo replikowane-go DNA gancyklovir zabija komórki z genem tk http:users.rcn.comjkimball.ma.ultranetBiologyPagesT TransgenicAnimals.htmlstep1 podwójna selekcja na G418 i gancyklovie: komórki nietransformowane są zabijane przez G418, komórki z przypadkową insercją są oporne na G418 lecz zabijane przez gancyklovir, tylko komórki z ukierunkowana insercją (dzięki rekombinacji homologicznej) przeżywają selekcję na G418 i gancyklovir
Slide 26
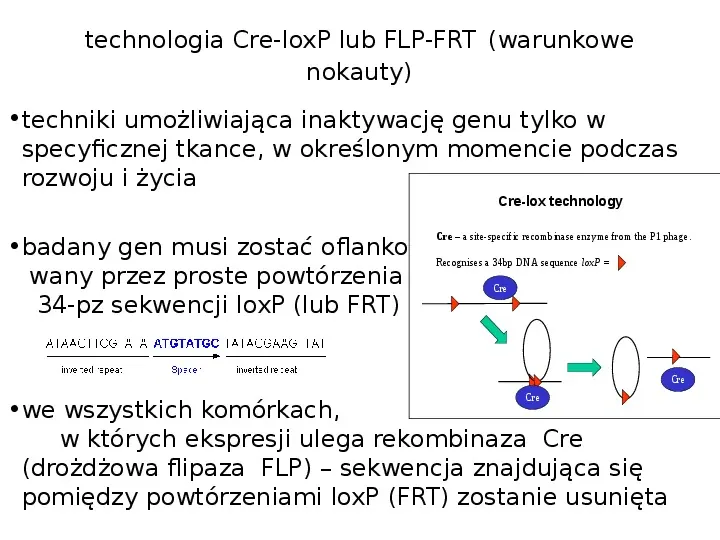
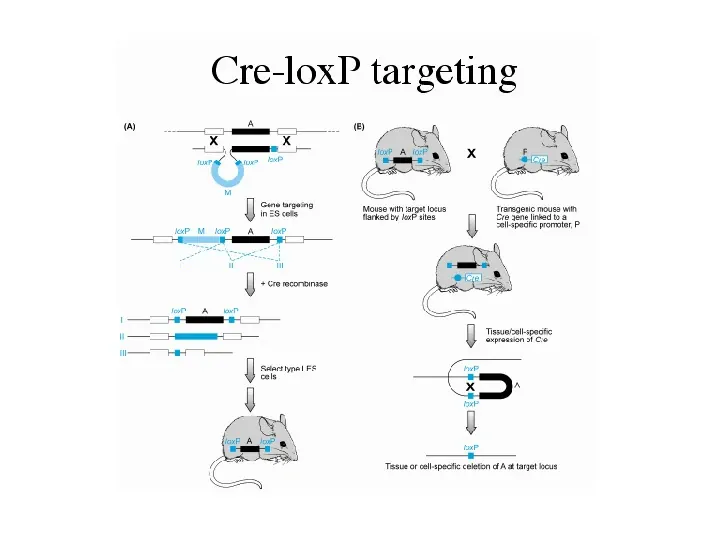
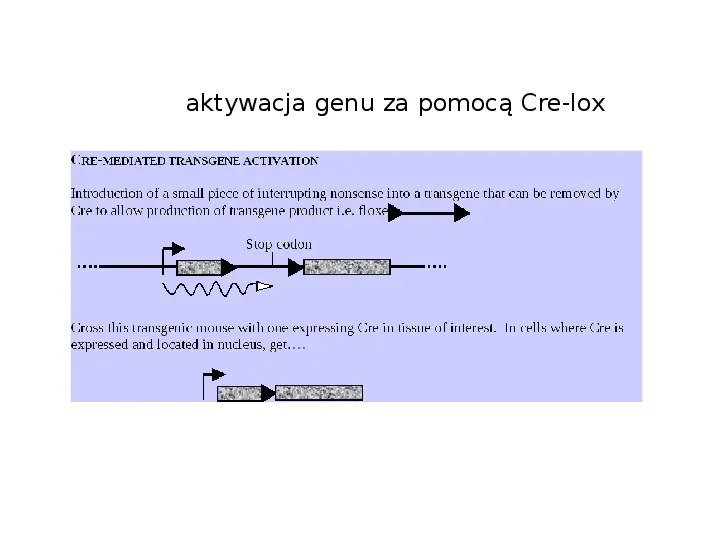
technologia Cre-loxP lub FLP-FRT (warunkowe nokauty) techniki umożliwiająca inaktywację genu tylko w specyficznej tkance, w określonym momencie podczas rozwoju i życia Cre-lox technology badany gen musi zostać oflankowany przez proste powtórzenia 34-pz sekwencji loxP (lub FRT) Cre a site-specific recombinase enzyme from the P1 phage. Recognises a 34bp DNA sequence loxP Cre Cre Cre we wszystkich komórkach, w których ekspresji ulega rekombinaza Cre (drożdżowa flipaza FLP) sekwencja znajdująca się pomiędzy powtórzeniami loxP (FRT) zostanie usunięta
Slide 27
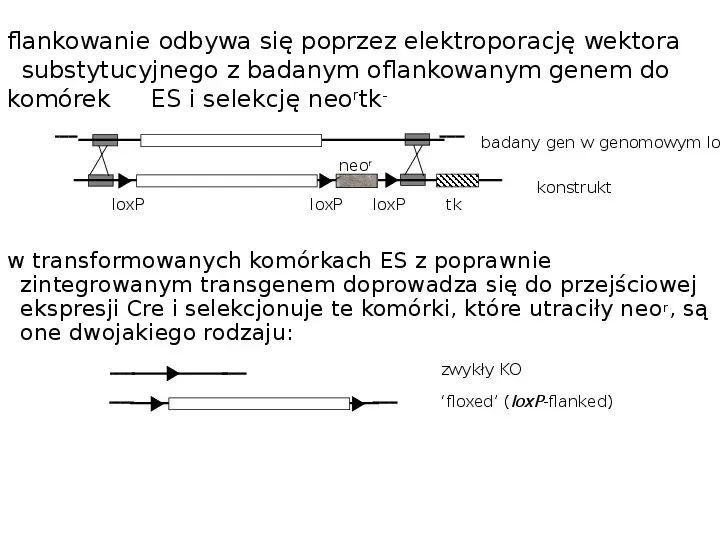
flankowanie odbywa się poprzez elektroporację wektora substytucyjnego z badanym oflankowanym genem do komórek ES i selekcję neortk- badany gen w genomowym lo neor loxP loxP loxP tk konstrukt w transformowanych komórkach ES z poprawnie zintegrowanym transgenem doprowadza się do przejściowej ekspresji Cre i selekcjonuje te komórki, które utraciły neo r, są one dwojakiego rodzaju: zwykły KO floxed (loxP-flanked)
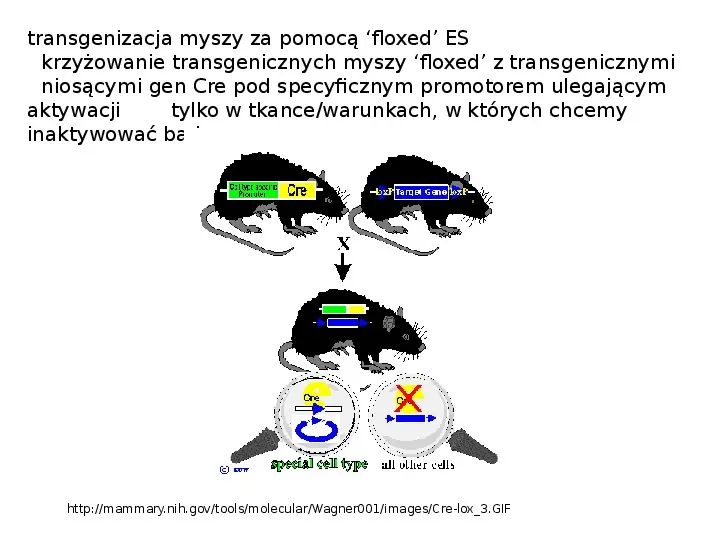
Slide 28
transgenizacja myszy za pomocą floxed ES krzyżowanie transgenicznych myszy floxed z transgenicznymi niosącymi gen Cre pod specyficznym promotorem ulegającym aktywacji tylko w tkancewarunkach, w których chcemy inaktywować badany gen http:mammary.nih.govtoolsmolecularWagner001imagesCre-lox3.GIF
Slide 32
aktywacja genu za pomocą Cre-lox
Slide 33
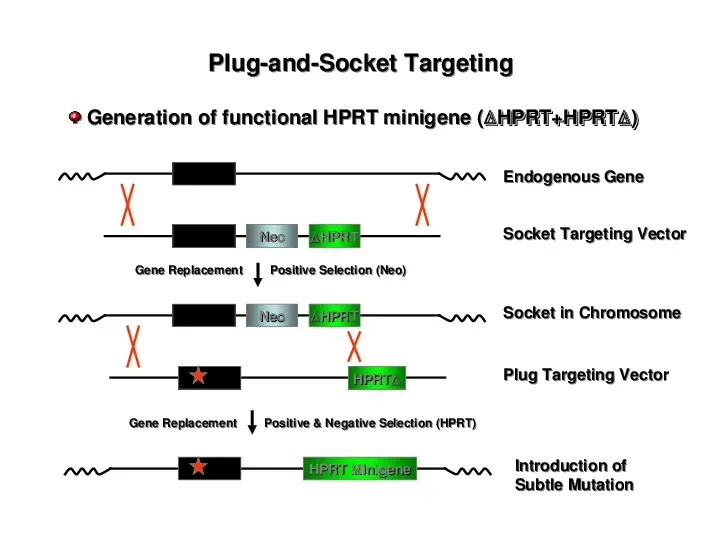
PlugandSocket Targeting Generation of functional HPRT minigene ( HPRTHPRT HPRTHPRT )) Endogenous Gene Neo HPRT Socket Targeting Vector Gene Replacement Positive Selection (Neo) Neo HPRT HPRT Socket in Chromosome Plug Targeting Vector Gene Replacement Positive Negative Selection (HPRT) HPRT Minigene Introduction of Subtle Mutation
Slide 34
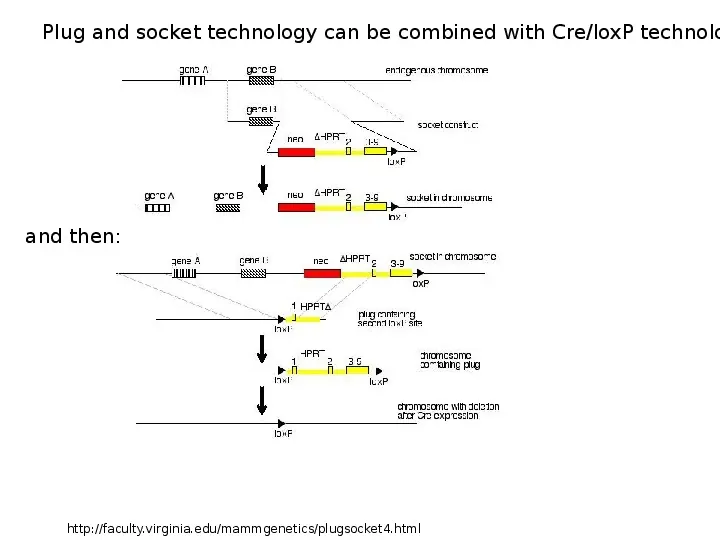
Plug and socket technology can be combined with CreloxP technolo and then: http:faculty.virginia.edumammgeneticsplugsocket4.html
Slide 35
myszy z KO pozwalają odkryć funkcje genów, dla których dotychczas nie istniały dostępne mutanty myszy z nokautem genowym zaskakująco często nie są upośledzone w wyniku ubytku genu wiele genów nie jest niezastąpionych mysi genom musi mieć pewien nadmiar genów kompensujących brakującą parę alleli większość genów jest plejotropowych w różnych tkankach ulegają ekspresji na różne sposoby i różnych okresach rozwojowych
Slide 36
Transgeniczne świnie można otrzymać w procedurze SMGT (sperm-mediated gene transfer) zapładniając normalne komórki jajowe plemnikami, do których DNA jest związany poprzez monoklonalne przeciwciało (mAb C), przeciwko powierzchniowemu antygenowi plemników (świńskich, mysich, kurzych, bydlęcych, kozich, owczych, ludzkich) . mAb C jest zasadowym białkiem wiążącym DNA poprzez interakcje jonowe i umożliwiającym specyficzna związanie DNA do plemników. Po zapłodnieniu DNA integruje do genomu.
Slide 37
transgeniczne kury lepsze niż transgeniczne kozy i owce rosną szybciej, duże ich ilości można hodować w zamkniętych pomieszczeniach białko jaja może zawierać nawet kilka gramów białek dwie metody tworzenia transgenicznych kur produkujących obce białko: infekcja zarodków wirusowym wektorem niosącym ludzki gen kodujący terapeutyczne białko poprzedzony promotorem powodującym tworzenie produktu genu w białku jaja transformowanie kurzych (kogucich!) plemników ludzkim genem pod odpowiednim promotorem obiema metodami można uzyskać kury, których jaja zawierają do 0.1 g ludzkiego białka koszty produkcji są niższe niż produkcji terapeutycznych białek w kulturach bakteryjnych, i dodatkowo kury najprawdopodobniej dodawałyby poprawne reszty cukrowe do glikozylowanych białek
Dane:
- Liczba slajdów: 37
- Rozmiar: 8.98 MB
- Ilość pobrań: 1037
- Ilość wyświetleń: 11313